Leclanché hücresi
Leclanché hücresi 1866 yılında Fransız bilim adamı Georges Leclanché tarafından icat edilen ve patentlenen bir bataryadır. Akü, amonyum klorür iletken bir solüsyonu (elektrolit), karbonun bir katotu (pozitif terminal), manganez dioksitin bir depolarizörü ve bir anodu (negatif terminal) içeren bir bataryadır. Bu hücrenin kimyası daha sonra kuru bir hücre üretmek üzere başarıyla uyarlandı.
Tarihi
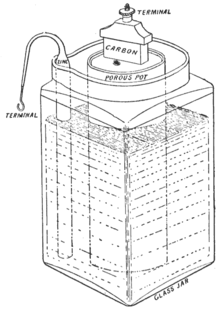
1866'da Georges Leclanché, çinko anot ve gözenekli bir malzemeye sarılan, amonyum klorür çözeltisi batırılmış manganez dioksit katottan oluşan bir pil keşfetti. Manganez dioksit katot, iletkenliğini ve emilimini artıran küçük karbon da karıştırıldı. 1,4 Volt gerilim sağladı. Bu hücre, telgraf, sinyalizasyon ve elektrikli çan çalışmalarında çok hızlı bir başarı elde etti.[1]
Kuru hücre formu, telefonlar telefon hattından güç çekmeden önce, genellikle telefonun duvarına yapıştırılmış bitişik bir ahşap kutudan erken telefonlara güç sağlamak için kullanıldı. Leclanché hücresi, çok uzun süre sürekli bir akım sağlayamadı. Uzun konuşmalarda, batarya tükenir ve konuşma duyulur hale gelir. Bunun nedeni, hücredeki bazı kimyasal reaksiyonların dahili direncini arttırması ve böylece voltajı düşürmesidir.[2] Bu reaksiyonlar, pil boşta kaldığında kendiliğinden ters gitti, bu yüzden yalnızca aralıklı kullanım için iyiydi.
Kimya
Bir Leclanché hücresinde elektrik üreten kimyasal süreç, anod yüzeyindeki çinko atomları oksitlediğinde başlar, diğer bir deyişle, hem pozitif yüklü iyonlar olmak üzere değerlik elektronlarından vazgeçerler. Çinko iyonları anottan uzaklaştıkça, elektronları yüzeyinde bıraktıklarında, anot katottan daha negatif yüklenir. Hücre harici bir elektrik devresine bağlandığında, çinko anod üzerindeki fazlalık elektronlar devre boyunca karbon çubuğa akar, elektronların hareketi elektrik akımı oluşturur.[3]
Bütün devreyi geçtikten sonra, elektronlar katottan (Karbon çubuk) girdiklerinde, manganez oksit (Mn2O3) ve negatif yüklü hidroksit iyonları üretmek için birbirleriyle reaksiyona giren manganez dioksit (MnO2) ve su (H2O) ile birleşirler. Buna, amonyak ve su molekülleri üretmek için amonyum klorid elektrolit içindeki pozitif amonyum iyonlarıyla negatif hidroksit iyonlarının reaksiyona girdiği ikincil bir reaksiyon eşlik eder.
Zn(s) + 2 MnO2(s) + 2 NH4Cl(aq) → ZnCl2 + Mn2O3(s) + 2 NH3(aq) + H2O
Alternatif olarak, reaksiyon daha da ilerlemekte, hidroksit iyonları manganez hidroksiti oluşturmak için manganez oksit ile de reaksiyona girmektedir.
Zn(s) + 2 MnO2(s) + 2 NH4Cl(aq) + 2H2O(l) → ZnCl2 + 2Mn(OH)2(s) + 2 NH3(aq)
Bir Leclanche hücresi tarafından üretilen elektromotik kuvvet (emf), gözenekli bir tencerenin kullanıldığı birkaç ohm dirençle birlikte 1.4 volttur. Telgraf, sinyal, elektrikli çalar ve aralıklı akımın gerekli olduğu benzer uygulamalarda yoğun kullanım gördü ve bir pilin az bakım gerektirmesi arzu edildi.
Leclanché bataryası (veya atıldığı ıslak hücre) modern çinko-karbon bataryasının (bir kuru hücre) öncüsü idi. Elektrolit macununa çinko klorür ilavesi e.m.f'yi yükseltti. Daha sonraki gelişmeler, amonyum klorürü tamamen boşaltarak iç direnci hızla artmayan (çinko klorür hücresi) daha fazla sürekli deşarja dayanıklı bir hücre elde etti.
Kaynakça
- http://micro.magnet.fsu.edu/electromag/electricity/batteries/zinccarbon.html
- "Arşivlenmiş kopya". 19 Mayıs 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 17 Nisan 2017.
- http://mysite.du.edu/~jcalvert/tel/morse/morse.htm