Baryum klorat
Baryum klorat formülü Ba(ClO3)2 olanbeyaz kristal yapıya sahip bir kimyasal bileşiktir. Tüm çözünür baryum bileşikleri gibi tahriş edici ve zehirlidir. Klorik asitin baryum tuzu olan bu bileşik diğer kloratlar gibi kuvvetli bir oksitleyicidir. Bazen piroteknikte yeşil bir renk üretmek için kullanılır. Klorik asit üretiminde de kullanılır.
| Baryum klorat | |
|---|---|
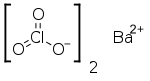 | |
 | |
Baryum diklorat | |
Diğer adlar Klorik asitin baryum tuzu | |
| Tanımlayıcılar | |
| CAS numarası | 13477-00-4 |
| PubChem | 26059 |
| RTECS numarası | FN9770000 |
| SMILES |
|
| InChI |
|
| ChemSpider | 24273 |
| Özellikler | |
| Molekül formülü | Ba(ClO3)2 |
| Molekül kütlesi | 304.23 gr/mol |
| Görünüm | beyaz katı |
| Yoğunluk | 3.18 gr/cm3 |
| Erime noktası |
413.9 °C ((bozunur)) |
| Çözünürlük (su içinde) | 27.5 gr/100 ml (20 °C) |
| Tehlikeler | |
| GHS piktogramları |    |
| GHS İşaret sözcüğü | Tehlike |
| R-ibareleri | R9, R20/22 |
| G-ibareleri | S13, S27 |
| H-ibareleri | H271, H302, H332, H411 |
| P-ibareleri | P210, P220, P221, P261, P264, P270, P271, P273, P280, P283, P301+312, P304+312, P304+340, P306+360, P312, P330, P370+378, P371+380+375, P391, P501 |
| NFPA 704 |
 0
3
3
|
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Reaksiyonları
Sentezi
Baryum klorat, baryum klorür ve sodyum klorat çözeltileri arasında yer değiştirme reaksiyonu ile üretilebilir:
- BaCl2 + 2 NaClO3 → Ba(ClO3)2 + 2 NaCl
Elde edilen karışımın konsantre edilmesi ve soğutulması üzerine baryum klorat çökelir.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.