Enzim ölçümü
Enzim ölçümleri enzim aktivitesini ölçmek için laboratuvar yöntemleridir. Enzim kinetiğini ve enzim inhibisyonunun araştırılması için önemlidirler.

Enzim birimleri
Enzim miktarları, diğer kimyasal bileşikler gibi, molar birim ile ifade edilebilir veya aktivite cinsinden enzim birimi ile ölçülebilir.
Enzim aktivitesi
Enzim aktivitesi, birim zaman başına dönüştürülen substrat mol sayısına eşittir, bir diğer deyişle reaksiyon hızı çarpı reaksiyon hacmine eşittir. Enzim aktivitesi mevcut aktif enzim miktarının bir ölçüsüdür ve dolayısıyla belirtilmesi gereken şartları bağlıdır. SI birimi katal'dır, 1 katal = 1 mol s−1 (1 mol/saniye)'dir ama bu aşırı büyük bir birimdir. Daha pratik ve yaygın kullanılan bir birim 1 enzim birimi = (U) = 1 μmol min−1. 1 U, 16.67 nanokatal'a eşittir.[1]
Katal olarak verilen enzim aktivitesi genelde enzimin doğal hedefi varsayılarak ifade edilir. Enzim aktivitesi bazı standart substratlar cinsinden de verilebilir. Örneğin, jelatin için jelatin sindirim birimleri (İngilizce gelatin digesting units veya GDU) veya süt proteinleri için süt pıhtılaştırma birimleri (İng. milk clotting units yani MCU) kullanılır. Bu birimler bir gram enzimin jelatin veya süt proteinleini ne hızla sindireceğini ifade eder. Bir GDU yaklaşık 1,5 MCU'ya eşittir.[2]
Spesifik aktivite
Bir enzimin spesifik aktivitesi yaygın kullanılan bir diğer birimdir. Bu, bir enzimin, 1 miligram toplam proteindeki aktivitesidir ve μmol dk−1mg−1 (mikromol bölü dakika bölü miligram) olarak ifade edilir. Spesifik aktivite enzim aktivitesinin bir ölçüsüdür. Toplam proteinin miligramı başına, belli bir süre zarfında ve belli şartlarda bir enzim tarafından meydana getirilen ürün miktarıdır. Spesifik aktivite reaksiyon hızı çarpı reaksiyon hacmi bölü toplam protein kütlesine eşittir. SI birimi katal kg−1'dir ama daha pratik bir birim μmol mg−1 dk−1'dir. Spesifik aktivite enzim ilerleyiciliğinin bir ölçüsüdür, belli bir substrat konsantrasyonunda (genelde enzimi doyurucu bir konsantrasyon kullanılır) ve saf enzim için genelde sabit bir değerdir. Enzimin saflaştırmasındaki veya diğer faktörlerdeki toplu iş (İng. batch) farklılıklarından kaynaklanan hataları bertaraf etmek için bir aktif bölge titrasyonu yapılması gerekir. Aktif bölge miktarını titre etmek için tersinmez bir enzim inhibitörü kullanılır, böylece aktif enzim miktarı ölçülür. Bu durumda, spesifik aktivite μmol min−1 mg−1 aktif enzim olarak ifade edilmelidir.
İlgili terminoloji
Reaksiyon hızı, birim zaman başına yok olan substrat (veya meydana gelen ürün) konsantrasyonudur (mol ).
% saflık, %100 × (enzim numunesinin spesifik aktvitesi / saf enzimin spesifik aktivitesi)'dir. Saf olmayan numunenin daha düşük bir spesifik aktivitesi olur çünkü kütlenin bir kısmı enzimden oluşmamaktadır. %100 saf enzimin spesifik aktivitesi biliniyorsa, saf olmayan bir numunenin spesifik aktivitesi daha düşük olacaktır, bu sayede saflık derecesi hesaplanabilir.
Ölçüm tipleri
Tüm enzim ölçümleri zamana bağlı olarak ya substrat tüketimini veya ürün üretimini ölçer. Substrat ve ürün konsantrasyonlarını ölçmek için çok sayıda farklı yöntem mevcuttur ve çoğu enzim birden çok yöntemle ölçülebilir. Biyokimyacılar genelde enzim tarafından katalizlenen reaksiyonları dört tip deney yoluyla çalışır:[3]
- İlk hız deneyleri. Bir enzim aşırı miktarda bir substrat ile karıştırılınca, geçici bir dönem boyunca enzim-substrat araürünü hızla birikir. Ardından, reaksiyon sabıt durum kinetiğine ulaşır, enzim-substrat araürün konsantrasyonu zaman içinde yaklaşık sabit kalır ve reaksiyon hızı nispeten yavaş değişir. Sabit duruma ulaşıldıktan kısa bir süre sonra reaksiyon hızı ölçülmeye başlanır, genelde zamana bağlı olarak ürünün birikmesi takip edilir. Ölçümler kısa bir süre için yapıldığı ve aşırı konsantrasyonda substrat kullanıldığı için, serbest substrat konsantrasyonun ilk substrat konsantrasyonuna yaklaşık eşit olduğu varsayımı yapılabilir. İlk hız deneyleri yapılması ve analizi en kolay ölçümlerdir, çünkü ters reaksiyon ve enzim yıkımı gibi komplikasyonlardan yoksundur. Bu yüzden enzim kinetik deneylerinde kullanılan en yaygın deneylerden biridir.
- İlerleme eğrisi deneyleri. Bu deneylerde, kinetik parametrelerin belirlenmesi için, zamana bağlı substrat ve ürün konsantrasyonlarını ifade eden denklemler kullanılır. İlk hızlı dönemin ardından, reaksiyonun dengeye ulaşmasına izin verecek kadar uzun bir süre için, substrat veya ürün konsantrasyonu zamana bağlı olarak kaydedilir. Günümüzde artık pek kullanılmamakla beraber, enzim kinetiği tarihinin ilk dönemlerinde ilerleme eğrisi deneyleri yaygın olarak kullanılırdı.
- Geçici kinetik deneyleri. Bu deneylerde, ilk hızlı dönem sırasında reaksiyon takip edilir, enzim-substrat araürünü sabit-durum kinetiği dönemine ulaşana kadar. Bu deneyler yukarıda belirtilen diğer iki yöntemden daha zordur çünkü hızlı karıştırma ve gözlemleme yöntemleri gerektirirler.
- Relaksasyon deneyleri. Bu deneylerde bir enzim substrat ve ürün karışımına bir perturbasyon uygulanır, örneğin sıcaklık, basınç veya pH'de ani bir değişiklik yapılarak, ve denge geri dönüş izlenir. Bu deneylerin analizi için tamamen tersinir reaksiyonun gözününe alınması gerekir. Üstelik, relaksasyon deneyleri mekanistik ayrıntıları nispeten duyarsızdır ve dolayıyla genelde mekanizmanın belirlenmesi için kullanılmaz.
Enzim ölçümleri örnekleme yöntmeleine göre iki gruba ayrılabilir: sürekli ölçümler'de aktivite sürekli olarak kaydedilir, süreksiz ölçümler'de ise düzenli zaman aralıklarında numuneler alınır, reaksiyon durudurulur ve substrat veya ürünlerin konsantrasyonları belirlenir.

Sürekli ölçümler
Sürekli ölçümler kullanışlıdır, fazladan bir işleme gerek kalmadan bir ölçüm ile reaksiyon hızı elde edilir. Sürekli ölçümlerin pek çok tipi vardır.
Spektrofotometrik
Spektrofotometrik ölçümlerde, reaksiyonun gidişini izlemek için reaksiyon solüsyonunun ne kadar ışık soğurduğuna bakılır. Eğer ışık görünür bölgede ise, reaksiyonun renginde bir değişiklik görülebilir, bunlara kolorimetrik ölçüm denir. Bir tetrazolyum boyasının substrat olarak kullanıldığı MTT ölçümü, kolorimetrik ölçüme örnektir.
Mor ötesi sıkça kullanılır çünkü NADH ve NADPH gibi çoğu koenzim, indirgenmiş hâllerinde mor ötesini soğurur ama yükseltgenmiş (okside) biçimlerinde soğurmaz. NADH'yi substrat olarak kullanan bir oksidoredüktaz'in aktivitesini ölçmek için 340 nm dalgaboyundaki mor ötesi soğurmasındaki azalmayı takip edilebilir.[4]
Doğrudan ve kenetli ölçümlerin kıyaslaması
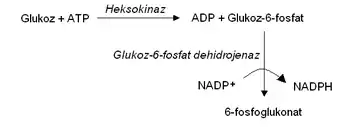
Enzim reaksiyonu ışık soğurmasında bir değişikliğe neden olmasa da, kenetli ölçüm (İng. coupled assay) kullanılarak enzim için spektrofotometrik bir ölçüm yapılabilir. Burada, bir reaksiyonun ürünü, kolayca izlenebilen başka bir reaksiyonun substratıdır. Örneğin, sağdaki şekilde heksokinaz enzimi için bir kenetli ölçüm gösterilmiştir. Bu enzimin ürettiği glukoz-6-fosfat, glukoz-6-fosfat dehidrojenaz aracılığıya, NADPH üretimine bağlanır.
Florometrik
Floresans, bir molekülün belli bir dalga boyunda ışık soğurduktan sonra başka bir dalga boyunda ışık salmasıdır. Florometrik enzim ölçümlerinde substrat floresansı ile ürün floresansı arasındaki farktan yararlanılır. Bu ölçümler spektrofotometrik ölçümlerden daha duyarlıdır ama bir dezavantajları, katışkılardan kaynaklanan enterferans ve çoğu floresan bileşiğin ışığa maruz kalınca bozulmalarıdır.
Bu ölçümlerin bir örneği, gnee nükleotit koenzimler NADH ve NADPH'nin kullanımıdır. Bu durumda, indirgenmiş (redüklenmiş) biçimler floresandır, yükseltgenmiş (okside) biçimler ise floresan değildir. Dolayısıyla, oksidasyon reaksiyonları floresans azalması ile, redüksiyon reaksiyonları da floreans artması ile izlenebilir.[5] Enzim tarafından katalizlenen reaksiyonlarda floresan boya salan sentetik sbstratlar da mevcuttur, β-galaktozidaz ölçümü için 4-metilumbelliferil-β-D-galactosit gibi.
Kalorimetrik

Kalorimetri kimyasal reaksiyonlarda yayılan veya emilen ısının ölçümüdür. Çoğu reaksiyon bir ısı değişimine yol açtığı için bu yöntem çok genel amaçlıdır. Bir mikrokalorimetre kullanılırsa ölçüm için az miktarda enzim veya substrat yeterlidir. Başka yolla ölçülemeyen reaksiyonlar bu ölçüm yöntemi ile takip edilebilir.[6]
Kemilüminesan
Kemilüminesans, bir kimyasal reaksiyon sonucu ışık salınmasıdır. Bazı enzim reaksiyonları ışık üretirler ve bu yolla ürün oluşumu ölçülebilir. Bu tip ölçümler çok duyarlı olabilir çünkü üretilen ışık fotoğraf filmi kullanılar günler veya haftalar boyunca yakalayabilir, ama nicelenmesi zor olabilir, çünkü salınan ışığın tamamı tespit edilmez.
Enzimatik kemilüminesans ile peroksidaz tespiti, Western blot ile antikorların tespiti için yaygın olarak kullanılır. Bir diğer örnek, ateş böceklerinden elde edilen lusiferaz enzimidir; bu enzim, substratı olan lusiferin ile reaksiyona girince ışık salar.
Işık saçılımı
Statik ışık saçılımı çözeltideki makromoleküllerin ağırlıklı molar kütlesi ile konsantrasyonlarının çarpımını ölçer. Saçılım sinyali, ölçüm sırasında, bir veya birkaç kimyasalın belli bir sabit toplam konsantrasyonu için, çözeltideki tüm bileşiklerin molar kütlesinin ağırlıklı hesaplanmış doğrudan ölçümüdür. Kompleksler oluştukça veya ayrıştıkça bu değer değişir. Dolayıyla bu ölçüm ile komplekslerin stokyometresi ve kinetiği nicelenir. Protein kinetiğinin ışık saçılımı ile ölçümü, enzim gerektirmeyen çok genel bir yöntemdir.
Süreksiz ölçümler
Süreksiz ölçümlerde, bir enzim reaksiyonundan düzenli aralıklarla numuneler alınır ve bunlardaki ürün oluşumu veya substrat tüketimi ölçülür.
Radyometrik
Radyometrik ölçümler substratların için radyoaktivite dahil oluşu veya substrattan ayrılması ölçülür. Bu ölçümlerde en sık kullanılan radyoaktif izotoplar 14C, 32P, 35S ve 125I'dir. Radyoaktif izotoplar bir substratın tek bir atomunun spesifik işaretlenmesine izin verdiği için, bu ölçümler hem çok duyarlı hem de spesifiktir. Biyokimyada sıkça kullanılırlar ve kaba lizatlarda (yani bir hücre parçalandığı zaman elde edilen karmaşık enzim karışımlarında) spesifik bir reaksiyonun izlenmesinin çoğu zaman tek yoludur.
Bu yöntemlerde radyoaktivite genelde sintilasyon sayacı ile ölçülür.
Kromatografik
Kromotagrafik ölçümlerde, reaksiyon karışımı kromatografi yoluyla bileşenlerine ayrıştırılıp ve ürün miktarı belirlenir. Genelde bunun için yüksek performansli sivi kromatografisi kullanılır ama daha basit bir teknik olan ince tabaka kromatografisi de kullanılabilir. Bu yaklaşım için çok miktarda malzeme gerekse de, substrat veya ürünler radyoaktif veya floresan etketle işaretlenerek duyarlılık artırılabilir. Daha yüksek basınçta çalışan kromatografi araçlarının kullanımıyla da ölçüm duyarlılığı artırılabilir (bakınız yüksek basınçlı sıvı kromtagorafisi#Pompa basıncı).[7]
Ölçümlerde kontrol edilecek faktörler
- Tuz konsantrasyonu: Çoğu enzim çok yüksek tuz konsatrasyonuna dayanamaz. Iyonlar, proteindeki zayıf iyon bağlarına etki eder. Tipik enzimler 1-500 mM tuz konsantrasyonları arasında çalışır. Tabii ki, halofilik (tuz seven) yosun ve bakterilerin enzimleri gibi istisnalar mevcuttur.
- Sıcaklık Etkileri: Tüm enzimler ait oldukları organizmaya has sıcaklık aralığında çalışır. Sıcaklığın artırılması genelde reaksiyon hızında artışa yol açar. Ancak belli bir optimumun üstünde sıcaklığın yükselmesi reaksiyon hızını azaltır, çünkü enzim aktif bölgesinin üç boyutlu yapısını stabilize eden iyonik bağlar ve hidrojen bağları kopmaya başlar.[8] İnsan enzimlerinde optimum sıcaklık genelde 35 ila 40 °C'dır. İnsan enzimleri 40 °C'ın üstünde hızla denatüre olmaya başlar. Sıcak su kaynaklarında (kaynarcalarda?) bulunan termofilik arkekerin enzimleri 100 °C'ye kadar stabildir.[9] Ancal, bir enzim için "optimum" bir hız olduğu fikti yanıltıcıdır çünkü belli bir sıcaklıkta gözlemlenen hız aslında iki sıcaklığın çarpımıdır, reaksiyon hızı ve denatürasyon hızı. Eğer bir saniye için enzim aktvitesi ölçesiniz yüksek sıcaklıkta daha yüksek bir hız bulabilirsiniz ama ürün oluşumunu bir saat boyunca ölçseniz, yüksek sıcaklıkta daha az ürün oluştuğunu bulursunuz.
- pH etkileri: Çoğu enzim pH'ye duyarlıdır ve belli bir pH aralığında etkinlik gösterir. Hepsinin ptimum bir pH'si vardır. Aşırı pH değerlerinde iyonik bağlar ve hidrojen bağlarının kırılır, bunun sonucu enzimin üç boyutlu yapısı değişir (denatüre olur) ve enzim aktivitesi durur. Çoğu enzim pH 6 ilas 8'de çalışır; ancak, midede bulunan pepsin en iyi pH 2'de, tripsin ise en iyi pH 8'de çalışır.
- Substrat doyumu: Substrat konsantrasyonunu artırmak reaksiyon hızını (enzim aktivitesini) artırır. Ancak, enzimin doyumu reaksiyon hızını sınırlar. Tüm enzim moleküllerinin aktif bölgesi hemen hep dolu olduğu zaman enzimin doymuş olur. Doyum noktasına ulaşılınca artık ne kadar daha çok substrat eklenirse eklensin reaksiyon daha çok hızlanmaz. Reksiyon grafiği plato yapar.
- Kalabalıklık derecesi: Çözeltideki yüksek miktarda makromolekül olması, makromoleküler kalabalıklaşma adı verilen bir etki ile, enzim reaksiyonlarının reaksiyon hızını ve denge sabitlerini etkiler.[10]
Ayrıca bakınız
Kaynakça
- Nomenclature Committee of the International Union of Biochemistry (NC-IUB) (1979). "Units of Enzyme Activity". Eur. J. Biochem. Cilt 97. ss. 319-20. doi:10.1111/j.1432-1033.1979.tb13116.x.
- How Many? A Dictionary of Units of Measurement By Russ Rowlett at the University of North Carolina at Chapel Hill
- Schnell, S., Chappell, M.J., Evans, N.D. Roussel, M.R. (2006). "The mechanism distinguishability problem in biochemical kinetics: The single-enzyme, single-substrate reaction as a case study". Comptes Rendus Biologies. 329 (1). ss. 51-61. doi:10.1016/j.crvi.2005.09.005. PMID 16399643.
- Bergmeyer, H.U. (1974). Methods of Enzymatic Analysis. 4. New York: Academic Press. ss. 2066-72. ISBN 089573236X.
- Passonneau, J.V., Lowry, O.H. (1993). Enzymatic Analysis. A Practical Guide. Totowa NJ: Humana Press. ss. 85-110.
- Todd MJ, Gomez J (Eylül 2001). "Enzyme kinetics determined using calorimetry: a general assay for enzyme activity?". Anal. Biochem. 296 (2). ss. 179-87. doi:10.1006/abio.2001.5218. PMID 11554713.
- Churchwella, M; Twaddlea, N; Meekerb, L; Doergea, D. (Ekim 2005). "Improving Sensitivity in Liquid Chromatography-Mass Spectrometry". Journal of Chromatography B. 825 (2). ss. 134-143.
- Daniel RM, Peterson ME, Danson MJ; ve diğerleri. (Ocak 2010). "The molecular basis of the effect of temperature on enzyme activity". Biochem. J. 425 (2). ss. 353-60. doi:10.1042/BJ20091254. PMID 19849667.
- Cowan DA (1997). "Thermophilic proteins: stability and function in aqueous and organic solvents". Comp. Biochem. Physiol. A Physiol. 118 (3). ss. 429-38. doi:10.1016/S0300-9629(97)00004-2. PMID 9406427.
- Minton AP (2001). "The influence of macromolecular crowding and macromolecular confinement on biochemical reactions in physiological media". J. Biol. Chem. 276 (14). ss. 10577-80. doi:10.1074/jbc.R100005200. PMID 11279227.