Florosülfürik asit
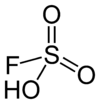
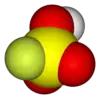
Florosülfürik asit (IUPAC adı: sülfuroflordik asit), HSO3F kimyasal formüllü bir inorganik bileşiktir. Ticari olarak temin edilebilen en güçlü asitlerden biridir. HSO3F formülü sülfürik asit, H2SO4 ile ilişkisini vurgulamaktadır. HSO3F tetrahedral bir moleküldür. Ticari numuneler genellikle sarı olmasına rağmen renksiz bir sıvıdır.[1]
| Florosülfürik asit | |
|---|---|
 |
 |
Sülfuroflordik asit | |
Diğer adlar Florosülfonik asit, Floridosülfonik asit, Sülfürik florohidrin, Epoksisülfonil florür | |
| Tanımlayıcılar | |
| CAS numarası | 7789-21-1 |
| PubChem | 24603 |
| ChemSpider | 23005 |
| Özellikler | |
| Molekül formülü | FHO3S |
| Molekül kütlesi | 100.06 g·mol−1 |
| Görünüm | Renksiz sıvı |
| Yoğunluk | 1.726 g cm−3 |
| Erime noktası |
−87.5 °C |
| Kaynama noktası |
165.4 °C |
| Asitlik (pKa) | -10 |
| Baziklik (pKb) | 24 |
| Tehlikeler | |
| Ana tehlikeler | Aşındırıcı |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Kimyasal özellikler
Florosülfürik asit serbest akan renksiz bir sıvıdır. Polar organik çözücülerde (örneğin nitrobenzen, asetik asit ve etil asetat) çözünür, ancak alkanlar gibi polar olmayan çözücülerde zayıf biçimde çözünür. Güçlü asitliğini yansıtarak, zayıf proton alıcıları olan hemen hemen tüm organik bileşikleri çözer.[2] HSO3F yavaşça HF ve sülfürik aside hidrolize olur. İlgili triflik asit (CF3SO3H), HSO3F'in yüksek asitliğini korur ancak daha hidrolitik olarak sabittir. Florosülfonik asidin kendi kendine iyonlaşması da meydana gelir.
2 HSO3F ⇌ [H2SO3F]+ + [SO3F]− K = 4.0 × 10−8 (298 K'de)
Üretim
Florosülfürik asit, HF ve kükürt trioksitin tepkimesi ile hazırlanır:[1]
SO3 + HF → HSO3F
Alternatif olarak, KHF2 veya CaF2, 250 °C'de oleum ile işlenebilir. HF'den atıl bir gaz ile süpürülerek serbest bırakıldığında, HSO3F bir cam aparatta damıtılabilir.
Uygulamalar
HSO3F, aşındırma kurşun camı için HF ve H2SO4 karışımlarının yenilenmesinde faydalıdır.
HSO3F, alkanları izomerleştirir ve hidrokarbonların alkenlerle alkilasyonunu sağlar,[3] ancak bu tür uygulamaların ticari öneme sahip olup olmadıkları açık değildir. Aynı zamanda, bir laboratuvar florlama maddesi olarak da kullanılabilir.[4]
Güvenlik
Florosülfürik asidin yüksek derecede toksik ve aşındırıcı olduğu kabul edilir. HF'yi serbest bırakmak için hidrolize olur. HSO3F'ye su ilavesi, sülfürik aside su ilavesine benzer, ancak daha şiddetli olabilir
Kaynakça
- Erhardt Tabel, Eberhard Zirngiebl, Joachim Maas "Fluorosulfuric Acid" in "Ullmann's Encyclopedia of Industrial Chemistry" 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a11_431
- Olah, G. A.; Prakash, G. K.; Wang, Q.; Li, X.-Y. (2001). "Fluorosulfuric Acid". Encyclopedia of Reagents for Organic Synthesis. Encyclopedia of Reagents for Synthesis. John Wiley & Sons. doi:10.1002/047084289X.rf014. ISBN 0471936235.
- Olah, G.; Farooq, O.; Husain, A.; Ding, N.; Trivedi, N.; Olah, J. (1991). "Superacid HSO3F/HF-Catalyzed Butane Isomerisation". Catalysis Letters. 10 (3–4): 239–247. doi:10.1007/BF00772077.
- Cotton, F. A.; Wilkinson, G. (1980). Advanced Inorganic Chemistry (4th ed.). New York: Wiley. p. 246. ISBN 0-471-02775-8.