Alüminyum hidrit
Alüminyum hidrit (ayrıca bilinen adıyla alan veya alumane), formülü AlH3 olan inorganik bileşik. Renksiz, piroforik ve katı bir maddedir. Araştırma laboratuvarlarının dışında nadiren karşılaşılmasına rağmen, alane ve türevleri organik sentezlerde indirgen madde olarak kullanılır.[1]
| Alüminyum hidrit | |
|---|---|
 | |
Alüminyum hidrit | |
Alumane | |
Diğer adlar Alan Alüminik hidrit | |
| Tanımlayıcılar | |
| CAS numarası | 7784-21-6 |
| PubChem | 14488 |
| ChEBI | 30136 |
| SMILES |
|
| InChI |
|
| Gmelin veritabanı | 245 |
| ChemSpider | 13833 |
| Özellikler | |
| Molekül formülü | AlH3 |
| Molekül kütlesi | 29.99 g/mol |
| Görünüm | beyaz kristal katı, uçucu olmayan, çok polimerleşmiş, iğne benzeri kristaller |
| Yoğunluk | 1.477 g/cm3, katı |
| Erime noktası |
150 °C |
| Çözünürlük (su içinde) | tepkir |
| Termokimya | |
Isı sığası (C) |
40.2 J/mol K |
Standart molar entropi (S |
30 K/mol K |
Standart formasyon entalpisi (ΔfH |
-11.4 kJ/mol |
Gibbs serbest enerjisi (ΔfG˚) |
46.4 kJ/mol |
| Benzeyen bileşikler | |
Benzeyen bileşikler |
Lityum alüminyum hidrit, diboran |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
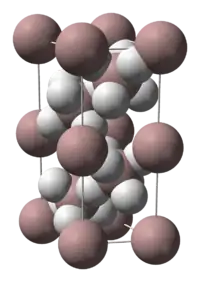
Yapısı
Alan bir polimerdir. Bu nedenle, bileşiğin formülü bazen (AlH3)n formülü ile gösterilir. α-alane, α’-alane, β-alane, γ-alane, δ-alane, ε-alane and ζ-alane diye adlandırılan sayısız polimorflardan oluşur. α-Alane, kübik veya karbohedral morfolojiye sahiptir. Buna karşılık α’-alane, iğne benzeri kristallerden oluşurken; γ-alane, erimiş iğne demetlerinden oluşur. Alan, THF ve eterde çözünür. Katı alanın eterde çökelme oranı hazırlama yöntemine göre değişir.[2]
α-alane'ın kristal yapısı kararlıdır ve 6 alüminyum atomuyla köprü oluşturan, 6 hidrojen atomuyla çevrili alüminyum atomlarını içerir. Al-H uzaklıklarının tümü eş değere (172pm) sahiptir. Al-H-Al açısı 141°dir.[3]
 |  |  |
α-Alane, sıklıkla termal olarak kararlı bir polimorftur. β-alane ve γ-alane, beraber üretilir ve ısıtılarak α-alane'a dönüşür. δ, ε ve θ-alane, diğer kristalleşme koşullarında üretilir. Termal olarak daha kararlı olmasına rağmen δ, ε ve θ polimorfları ısıtmayla α-alane'a dönüşmez.[2]
Hazırlanışı
Alüminyum hidritler ve bunların çeşitli kompleksleri uzun zamandır bilinmektedir.[7] İlk sentezi 1947 yılında ve 1999 yılında sentez için bir patent alındı.[8][9] Alüminyum hidrit, alüminyum triklorit ile lityum alüminyum hidritin kimyasal işleme tutulmasıyla hazırlanır.[10] Karmaşık olan bu işlemde, lityum klorür'ün çıkarılmasında dikkatli olunmalıdır.
- 3 LiAlH4 + AlCl3 → 4 AlH3 + 3 LiCl
Katı hâldeki madde hızla çöktüğünden alan'ın eter çözeltisinin derhal kullanılması gerekir. Alüminyum hidrit çözeltisinin 3 gün sonra yükseltgendiği bilinmektedir. Alüminyum hidrit, LiAlH4 bileşiğinden daha reaktiftir.[2]
Alüminyum hidritin hazırlandığı diğer yöntemler aşağıdaki gibidir:
- 2 LiAlH4 + BeCl2 → 2 AlH3 + Li2BeH2Cl2
- 2 LiAlH4 + H2SO4 → 2 AlH3 + Li2SO4 + 2 H2
- 2 LiAlH4 + ZnCl2 → 2 AlH3 + 2 LiCl + ZnH2
Elektrokimyasal sentez
Birkaç grup, alan'ın elektrokimyasal olarak üretilebildiğini göstermiştir.[11][12][13][14][15] Alan'ın elektrokimyasal olarak üretilen farklı yöntemlerinin patenti alınmıştır.[16][17] Elektrokimyasal olarak üretilen alan, klorür yabancı maddelerini önler. Clasen'in çözücü olarak THF'yi, elektrolit olarak sodyum alüminyum hidrit, bir alüminyum anotu ve katot olarak cıvaya (Hg) batırılmış bir demir (Fe) telini içeren elektrokimyasal hücresinde alan'ın oluşumu için iki olası mekanizma tartışılmaktadır. Sodyum, HG katotu ile yan rekasyionları önleyen bir amalgam oluşturur. İlk reaksiyonda üretilen hidrojen yakalanabilir ve sodyum hidrit üretmek için sodyum cıva amalgamı ile geri tepkimeye sokulabilir. Clasen'in sisteminde başlangıç malzemesi kaybolmaz. Çözülmeyen bir anot için 1. reaksiyona bakın.
1. AlH4− - e− → AlH3 · nTHF + ½H2 Çözünebilen anotlar için, 2. reaksiyona göre anodik çözünme beklenir,
2. 3AlH4− + Al - 3e− → 4AlH3 · nTHF 2. reaksiyonda alüminyum anotu tüketilir, belirli bir elektrokimyasal hücre için alüminyum hidrit üretimini sınırlar.
Alüminyum hidritin elektrokimyasal olarak üretilen alan'dan kristalleşmesi ve geri kazanımı gösterilmiştir.[14][15]
Alüminyum metalinin yüksek basınçlı hidrojenasyonu
α-AlH3, 10GPa ve 600 °C (1.112 °F) koşullarında alüminyum metalinin hidrojenasyonuyla üretilebilir. Sıvılaştırılmış hidrojen arasındaki reaksiyon, ortam koşullarında geri kazanılabilen α-AlH3 üretir.[18]
Reaksiyonları
Lewis bazlarıyla eklenme ürünlerinin oluşumu
AlH3, kolaylıkla Lewis bazlarıyla eklenme ürünü oluşturur. Örneğin trimetilamin ile 1:1 ve 1:2 kompleksleri oluşturur. 1:1 kompleksi, gaz fazında dört yüzlü,[19] ama katı fazda, köprü oluşturan hidrojen merkezleri (NMe3Al(μ-H))2 ile dimerik olur.[20] 1:2 kompleksi, trigonal bipiramidal bir yapıya sahiptir.[19] Bazı eklenme ürünleri (Örn; dimetiletilamin alan, NMe2Et · AlH3), alüminyum metali vermek için termal olarak ayrışır ve böylelikle MOCVD uygulamalarında kullanılabilir.[21]
Dietil eter ile kompleksi aşağıdaki tamkatlamaya göre oluşur:
- AlH3 + (C2H5)2O → H3Al · O(C2H5)2
Eterin içindeki lityum hidrit ile reaksiyonu, lityum alüminyum hidrit üretir:
- AlH3 + LiH → LiAlH4
Fonksiyonel grupların indirgenmesi
Organik kimyada alüminyum hidrit, ağırlıklı olarak fonksiyonel grupların indirgenmesinde kullanılır.[22] Birçok yoldan alüminyum hidritin reaktifliği, lityum alüminyum hidrit bileşiğine benzer. Alüminyum hidrit; aldehitler, ketonlar, karboksilik asitler, anhidritler, açil klorürler, esterler ve laktonları kendi alkollerine indirger. Amitler, nitriller ve oksimler aminlere indirgenir.
Fonksiyonel grup seçiciliği açısından alan, diğer hidrit reaktiflerinden farklıdır. Buna örnek olarak; aşağıdaki siklohekzanon indirgenmesinde lityum alüminyum hidrit, 1.9 : 1 oranında trans:cis verirken alüminyum hidrit, 7.3 : 1 oranında trans:cis verir.[23]
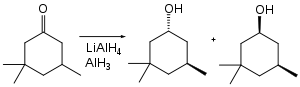
Alan, bazı ketonların hidroksimetilasyonunu, yani C-H'nin C-CH2OH ile yer değiştirmesini sağlar.[24] Keton, enolat olarak "korunduğu" için indirgenmez.
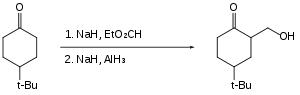
Halokarbonlar, alüminyum hidrit ile yavaşça indirgenir veya hiç indirgenmez. Bu nedenle karboksilik asitler gibi reaktif fonksiyonel gruplar, halojenürlerin varlığında indirgenebilirler.[25]
Azor grupları, alüminyum hidrit ile indirgenmez. Benzer şekilde alüminyum hidrit, azot gruplarının varlığında esterin indirgenmesini sağlayabilir.[26]
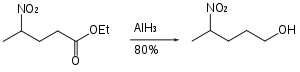
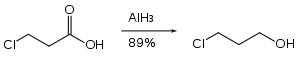
Alüminyum hidrit, asetallerin yarı korunmuş diollere indirgenmesinde kullanılabilir.[27]
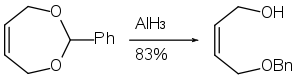
Alüminyum hidrit, ayrıca aşağıda gösterildiği gibi epoksit halka açma reaksiyonunda da kullanılabilir.[28]

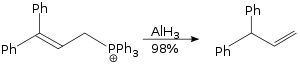
Alüminyum hidrid kullanılarak gerçekleştirilen allilik yeniden düzenlenme reaksiyonu, bir SN2 reaksiyonudur ve sterik olarak talep edilmemektedir.[29]
Alüminyum hidrit, metanın ısıtılması için karbondioksiti de indirger.
- 4 AlH3 + 3 CO2 → 3 CH4 + 2 Al2O3
Hidroalüminasyon
Alüminyum hidritin propargil alkollere eklendiği gösterilmiştir.[30] Hidroborasyon benzeri bir reaksiyon olarak, titanyum tetraklorür ile birlikte kullanıldığında çift bağlara katlanabilir.[31]
Yakıt
Alüminyum hidrit, hidrojen yakıtlı araçlarda hidrojenin depolanması için tartışılmıştır. 148g/L'ye karşılık gelen AlH3, ağırlıkça %10'a kadar hidrojen içerir ve H2 sıvısının iki katıdır. Ancak, AlH3 geri dönüşümlü bir hidrojen taşıyıcısı değildir.[32] Patlayıcı ve piroteknik bileşimlerde roket yakıtına potansiyel bir katkıdır.
Önlemler
Alüminyum hidrit kendiliğinden yanıcı değildir, ama lityum alüminyum hidrite benzer şekilde oldukça reaktiftir. Hava ve suda parçalanır. Her ikisinde de şiddetli reaksiyonlar oluşur.[2] AlH3, alüminyum oksitin koruyucu tabakasıyla havada dikkatle, güvenli bir şekilde ele alınabilir.[32]
Kaynakça
- Brown, H. C.; Krishnamurthy, S. (1979). "Forty Years of Hydride Reductions". Tetrahedron. 35 (5). ss. 567-607. doi:10.1016/0040-4020(79)87003-9.
- US application 2007066839, Lund, G. K.; Hanks, J. M.; Johnston, H. E., "Method for the Production of α-Alane"
- Turley, J. W.; Rinn, H. W. (1969). "The Crystal Structure of Aluminum Hydride". Inorganic Chemistry. 8 (1). ss. 18-22. doi:10.1021/ic50071a005.
- Kurth, F. A.; Eberlein, R. A.; Schnöckel, H.-G.; Downs, A. J.; Pulham, C. R. (1993). "Molecular Aluminium Trihydride, AlH3: Generation in a Solid Noble Gas Matrix and Characterisation by its Infrared Spectrum and ab initio Calculations". Journal of the Chemical Society, Chemical Communications. 1993 (16). ss. 1302-1304. doi:10.1039/C39930001302.
- Andrews, L.; Wang, X. (2003). "The Infrared Spectrum of Al2H6 in Solid Hydrogen". Science. 299 (5615). ss. 2049-2052. Bibcode:2003Sci...299.2049A. doi:10.1126/science.1082456. PMID 12663923.
- Pulham, C. R.; Downs, A. J.; Goode, M. J.; Rankin D. W. H.; Robertson, H. E. (1991). "Gallane: Synthesis, Physical and Chemical Properties, and Structure of the Gaseous Molecule Ga2H6 as Determined by Electron Diffraction". Journal of the American Chemical Society. 113 (14). ss. 5149-5162. doi:10.1021/ja00014a003.
- Brower, F. M.; Matzek, N. E.; Reigler, P. F.; Rinn, H. W.; Roberts, C. B.; Schmidt, D. L.; Snover, J. A.; Terada, K. (1976). "Preparation and Properties of Aluminum Hydride". Journal of the American Chemical Society. 98 (9). ss. 2450-2454. doi:10.1021/ja00425a011.
- Finholt, A. E.; Bond, A. C. Jr.; Schlesinger, H. I. (1947). "Lithium Aluminum Hydride, Aluminum Hydride and Lithium Gallium Hydride, and Some of their Applications in Organic and Inorganic Chemistry". Journal of the American Chemical Society. 69 (5). ss. 1199-1203. doi:10.1021/ja01197a061.
- US patent 6228338, Petrie, M. A.; Bottaro, J. C.; Schmitt, R. J.; Penwell, P. E.; Bomberger, D. C., "Preparation of Aluminum Hydride Polymorphs, Particularly Stabilized α-AlH3", Veriliş tarihi: 2001-05-08
- Schmidt, D. L.; Roberts, C. B.; Reigler, P. F.; Lemanski, M. F. Jr.; Schram, E. P. (1973). "Aluminum Trihydride-Diethyl Etherate: (Etherated Alane)". Inorganic Syntheses. Inorganic Syntheses. Cilt 14. ss. 47-52. doi:10.1002/9780470132456.ch10. ISBN 9780470132456.
- Alpatova, N. M.; Dymova, T. N.; Kessler, Yu. M.; Osipov, O. R. (1968). "Physicochemical Properties and Structure of Complex Compounds of Aluminium Hydride". Russian Chemical Reviews. 37 (2). ss. 99-114. Bibcode:1968RuCRv..37...99A. doi:10.1070/RC1968v037n02ABEH001617.
- Semenenko, K. N.; Bulychev, B. M.; Shevlyagina, E. A. (1966). "Aluminium Hydride". Russian Chemical Reviews. 35 (9). ss. 649-658. Bibcode:1966RuCRv..35..649S. doi:10.1070/RC1966v035n09ABEH001513.
- Osipov, O. R.; Alpatova, N. M.; Kessler, Yu. M. (1966). "none". Elektrokhimiya. Cilt 2. s. 984.
- Zidan, R.; Garcia-Diaz, B. L.; Fewox, C. S.; Stowe, A. C.; Gray, J. R.; Harter, A. G. (2009). "Aluminium hydride: a reversible material for hydrogen storage". ChemComm, 25. ss. 3717-3719. doi:10.1039/B901878F.
- Martinez-Rodriguez, M. J.; Garcia-Diaz, B. L.; Teprovich, J. A.; Knight, D. A.; Zidan, R. (2012). "Advances in the electrochemical regeneration of aluminum hydride". Applied Physics A: Materials Science & Processing. 106 (25). ss. 545-550. Bibcode:2012ApPhA.106..545M. doi:10.1007/s00339-011-6647-y.
- DE patent 1141623, Clasen, H., "Verfahren zur Herstellung von Aluminiumhydrid bzw. aluminiumwasserstoffreicher komplexer Hydride", Veriliş tarihi: 1962-12-27, Veren: Metallgesellschaft
- US patent 8470156, Zidan, R., "Electrochemical process and production of novel complex hydrides", Veriliş tarihi: 2013-06-25, Veren: Savannah River Nuclear Solutions, LLC
- Saitoh, H; Sakurai, Y; Machida, A; Katayama, Y; Aoki, K (2010). "In situX-ray diffraction measurement of the hydrogenation and dehydrogenation of aluminum and characterization of the recovered AlH3". Journal of Physics: Conference Series. Cilt 215. s. 012127. Bibcode:2010JPhCS.215a2127S. doi:10.1088/1742-6596/215/1/012127. ISSN 1742-6596.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd bas.). Butterworth-Heinemann. ISBN 0080379419.
- Atwood, J. L.; Bennett, F. R.; Elms, F. M.; Jones, C.; Raston, C. L.; Robinson, K. D. (1991). "Tertiary Amine Stabilized Dialane". Journal of the American Chemical Society. 113 (21). ss. 8183-8185. doi:10.1021/ja00021a063.
- Yun, J.-H.; Kim, B.-Y.; Rhee, S.-W. (1998). "Metal-Organic Chemical Vapor Deposition of Aluminum from Dimethylethylamine Alane". Thin Solid Films. 312 (1-2). ss. 259-263. Bibcode:1998TSF...312..259Y. doi:10.1016/S0040-6090(97)00333-7.
- Galatsis, P. (2001). "Diisobutylaluminum Hydride". Encyclopedia of Reagents for Organic Synthesis. Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rd245. ISBN 978-0-470-84289-8.
- Ayres, D. C.; Sawdaye, R. (1967). "The Stereoselective Reduction of Ketones by Aluminium Hydride". Journal of the Chemical Society B. Cilt 1967. ss. 581-583. doi:10.1039/J29670000581.
- Corey, E. J.; Cane, D. E. (1971). "Controlled Hydroxymethylation of Ketones". Journal of Organic Chemistry. 36 (20). ss. 3070-3070. doi:10.1021/jo00819a047.
- Jorgenson, Margaret J. (Temmuz 1962). "Selective reductions with aluminum hydride". Tetrahedron Letters. 3 (13). ss. 559-562. doi:10.1016/S0040-4039(00)76929-2.
- Takano, S.; Akiyama, M.; Sato, S.; Ogasawara, K. (1983). "A Facile Cleavage of Benzylidene Acetals with Diisobutylaluminum Hydride" (pdf). Chemistry Letters. 12 (10). ss. 1593-1596. doi:10.1246/cl.1983.1593.
- Richter, W. J. (1981). "Asymmetric Synthesis at Prochiral Centers: Substituted 1,3-Dioxolanes". Journal of Organic Chemistry. 46 (25). ss. 5119-5124. doi:10.1021/jo00338a011.
- Maruoka, K.; Saito, S.; Ooi, T.; Yamamoto, H. (1991). "Selective Reduction of Methylenecycloalkane Oxides with 4-Substituted Diisobutylaluminum 2,6-Di-tert-butylphenoxides". Synlett. 1991 (4). ss. 255-256. doi:10.1055/s-1991-20698.
- Claesson, A.; Olsson, L.-I. (1979). "Allenes and Acetylenes. 22. Mechanistic Aspects of the Allene-Forming Reductions (SN2' Reaction) of Chiral Propargylic Derivatives with Hydride Reagents". Journal of the American Chemical Society. 101 (24). ss. 7302-7311. doi:10.1021/ja00518a028.
- Corey, E. J.; Katzenellenbogen, J. A.; Posner, G. H. (1967). "New Stereospecific Synthesis of Trisubstituted Olefins. Stereospecific Synthesis of Farnesol". Journal of the American Chemical Society. 89 (16). ss. 4245-4247. doi:10.1021/ja00992a065.
- Sato, F.; Sato, S.; Kodama, H.; Sato, M. (1977). "Reactions of Lithium Aluminum Hydride or Alane with Olefins Catalyzed by Titanium Tetrachloride or Zirconium Tetrachloride. A Convenient Route to Alkanes, 1-Haloalkanes and Terminal Alcohols from Alkenes". Journal of Organometallic Chemistry. 142 (1). ss. 71-79. doi:10.1016/S0022-328X(00)91817-5.
- Graetz, J.; Reilly, J.; Sandrock, G.; Johnson, J.; Zhou, W. M.; Wegrzyn, J. (2006). "Aluminum Hydride, A1H3, As a Hydrogen Storage Compound". doi:10.2172/899889.
Dış bağlantılar
- EnvironmentalChemistry.com sitesinde Alüminyum Hidrit Kimyasal Veritabanı
- Brookhaven National Laboratory sitesinde Hidrojen Depolama
- WebElements sitesinde Alüminyum Trihidrit