Bağırsak geçirgenliği
Bağırsak geçirgenliği, bağırsak duvarını kaplayan hücrelerden vücudun geri kalan kısmına, yani besin maddeleri sindirim sisteminin içinden geçerken bir kısmının vücudun sindirim sistemi dışına geçişinin kontrolünü tarif eden bir terimdir. Bağırsakların normal olarak sindirilmiş besin maddelerinin ve sindirilmeden faydalı olan vitamin ve minerallerin duvarından geçmesine izin veren bir miktar geçirgenlik sergilemeye ek olarak, aynı zamanda antijenler ve sindirilmemiş besinler gibi zararlı olabilecek maddelerin bağırsaktan çıkmasını ve vücuda daha fazla yayılmasını engelleme işlevi vardır.[1]
Sağlıklı bir insan bağırsağında, yarıçapı 4 Å dan küçük olan parçacıklar Sıkı bağlantı düzenli Claudin gözenek yollarından geçebilirler.[2]. Yarıçapı 10-15 – (3.5 kDa) 'ya kadar olan parçacıklar bağırsak duvar hücreleri arasından yani paraselüler boşluk alım yolundan geçebilir. Ayrıca duvar hücreleri içinden yani transsellüler yoldan taşınanlar da vardır.[3]
Fizyoloji
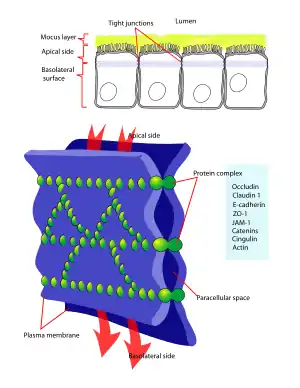
Alt: Protein kompleksi (yeşil) ve onu oluşturan moleküller ile büyük bir artışa yakın bir bağlantı. Kırmızı oklar, hücre geçirgenliği arttığında maddelerin hücre içi boşluklardan akış yönünü gösterir.
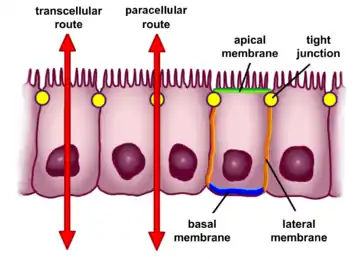
Epitel hücreleri seçici geçirgenlik sergiler. Transselüler (hücreler içinden) ve paraselüler (hücreler arasından) yollar, maddelerin bağırsaktan kana geçişini kontrol eder.
Bağırsak epitelinin oluşturduğu engel dış ortamı (bağırsak içeriğini) vücuttan ayırır[4] ve vücudun en geniş ve önemli mukozal yüzeyidir.[5] Bağırsak epiteli, tek bir hücre katmanından oluşur ve iki önemli işlevi vardır. Birincisi, yabancı antijenler, toksinler ve mikroorganizmalar gibi zararlı maddelerin girişini engelleyerek bir engel görevi görür.[4][6] İkincisi, besin, elektrolit, su ve bağırsak içeriğinden diğer çeşitli yararlı maddelerin alımını kolaylaştıran seçici bir filtre görevi görür.[4] Seçici geçirgenliğe iki ana yoldan aracılık edilir:[4]
- Transepitelyal veya transselüler geçirgenlik. Bu, epitel hücrelerinde belirli çözelti maddelerin taşınmasından oluşur. Ağırlıklı olarak, spesifik elektrolitleri, amino asitleri, şekerleri, kısa zincirli yağ asitlerini ve diğer molekülleri hücre içine almaya veya hücreden dışarı bırakmaya yarayan uzmanlaşmış taşıyıcıların faaliyetleri ile düzenlenir.[4]
- Paraselüler geçirgenlik. Epitel hücreleri arasında var olan boşluklar boyunca taşınmaya bağlıdır.[4] Hücrelerin yan yüzey (laminal) zarlarında yer alan sıkı bağlantılar ile düzenlenir. Bu, pasif su ve diger çözeltilerin bağırsak epiteli boyunca ana yoludur. Düzenleme, paraselüler nakil üzerinde en fazla etkiye sahip olan hücreler arası sıkı bağlantılara bağlıdır.[7] sıkı bağlantıların bozulması, bağırsak hastalıklarının gelişimi için bir tetikleyici olabilir.
Modülasyon
Bağırsak geçirgenliğinin modüle edilmesinin bir yolu, zonüline cevap veren, bağırsak epitelindeki hücrelerde bulunan CXCR3 reseptörleridir.[8]
Otoimmünitenin genetik oluşumundan bağımsız olarak, gliadin (buğdayda bulunan bir glikoprotein), glüten yiyen tüm insanlarda zonulin sinyalini aktive eder. Bu bağırsak geçirgenliğinin makromoleküller için artmasına neden olur.[8][9][10] Kolera, bazı enterik virüsler ve parazitler gibi bakteriyel patojenler, bağırsak duvarındaki sıkı bağlantı yapısını ve işlevini etkiler, ve bu kronik bağırsak bozuklukların gelişimine katkıda bulunabilir.[8][11] Stres ve enfeksiyonlar ayrıca bağırsak geçirgenliğinde de bozulmalara neden olur gibi görünmektedir.[9]
Klinik önemi
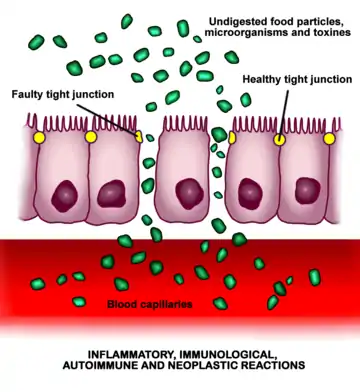
Hücreler arasında yer alan sıkı bağlantıların açılması (artan bağırsak geçirgenliği), maddelerin kontrolsüz bir şekilde kan dolaşımına geçişine izin verebilir, bu da daha sonra olası bağışıklık ve / veya enflamatuar reaksiyonların gelişmesine sebep olabilir.
Çoğu insan yan etki yaşamaz, ancak hücre içi sıkı bağlantıların açılması (artan bağırsak geçirgenliği), genetik yatkınlığa bağlı olarak herhangi bir organı veya dokuyu etkileyebilecek hastalıklar için tetikleyici olabilir.[8][10][12] Bakteriyel translokasyon[13] olarak bilinen bakterilerin ve hücre dışı veziküller (ESV'ler) gibi mikrobiyal ürünlerin ve yabancı antijenlerin mukozaya ve vücuda uygun şekilde geçişine izin verebilir. Bu bağışıklık sisteminin aktivasyonu ve enflamatuar mediatörlerin salgılanmasıyla sonuçlanabilir.[14]
Artan bağırsak geçirgenliği, Crohn hastalığı, Çölyak hastalığı,[15] tip 1 diyabet,[16] tip 2 diyabet,[15] romatoid artrit, spondiloartropatiler,[17] enflamatuar bağırsak hastalığı,[8][18] gibi çeşitli hastalıklarda bir faktördür. irritabl bağırsak sendromu,[9] şizofreni,[19][20] belirli kanser türleri,[8] obezite,[21] yağlı karaciğer,[22] atopi ve alerjik hastalıklar,[16] ve başkaları. Vakaların çoğunda, hastalıktan önce artan geçirgenlik gelişir,[8] ancak bu hastalıkların çoğunda artan bağırsak geçirgenliği arasındaki neden-sonuç ilişkisi açık değildir.[18][23]
Otizmle bir ilişki varsayılmıştır ancak bu teoriyi destekleyen veriler sınırlı ve çelişkilidir, çünkü hem artan bağırsak geçirgenliği hem de normal geçirgenlik otizmi olan kişilerde belgelenmiştir. Farelerle yapılan çalışmalar bu hipoteze bir miktar destek vermektedir.[24]
İyi incelenmiş bir örnek, glüten tarafından tetiklenen anormal immün reaksiyona sekonder olarak artan bağırsak geçirgenliğinin artması ve gliadin protein fragmanlarının intestinal epitelden geçmesine olanak sağlayarak, çeşitli gastrointestinal sinyale neden olan bir intestinal submukoz seviyesinde bir immün yanıtı tetiklemesine izin veren, veya sindirim sistemi dışında semptomlara sebep olan çölyak hastalığıdır.[25][26] Başka çevresel tetikleyiciler de çölyak hastalığında bağırsak enfeksiyonları ve demir eksikliği gibi geçirgenliğin etkilenmesine katkıda bulunabilir.[25] Bir kez kurulduktan sonra, bu geçirgenlik artışı, iltihabik bağışıklık tepkilerini kendi kendine sürdürebilir ve kısır döngüyü devam ettirebilir.[25] Diyetten glütenin çıkarılması bağırsak geçirgenliğinin normalleşmesine yol açar ve otoimmün süreç biter.[27]
Araştırma yönleri
Normal fizyolojide, glutamin, bağırsak bariyerinin bir parçası olan enterositlerde sinyalleşmede kilit bir rol oynar, ancak diyetin glutamin ile takviye edilmesinin, barsak geçirgenliğinin artmış olduğu durumlarda yararlı olup olmadığı açık değildir.[28]
Prebiyotikler ve Escherichia coli Nissle 1917 gibi bazı probiyotiklerin artmış bağırsak geçirgenliğini azattığı gözlemlenmiştir. Lactobacillus rhamnosus,[29] Lactobacillus reuteri,[29] ve Faecalibacterium prausnitzii 'nin artan bağırsak geçirgenliğini önemli ölçüde azalttığı gösterilmiştir.[30]
Larazotid asetat (daha önce AT-1001 olarak bilinir), klinik çalışmalarda araştırılmış bir zonulin reseptör antagonistidir. Glutensiz diyetle birlikte, çölyak hastalığı olan kişilerde, glutenin ve bunun epitelden geçişinin yol açtığı bağırsak geçirgenliğini azaltmak ve bu nedenle bağışıklık reaksiyonlarının kaskadını hafifletmek amacıyla kullanılmak üzere bir ilaç adayı gibi görünmektedir.[26][31]
Paleo-Ketojenik diyet (PKD, yani et, ve yağ, zamanla bazı sebzelerin de yenilebildiği yemek rejimi) uygulamanın, bağırsak geçirgenliği bozukluklarını ve buna bağlı otoimmün hastalıkları tedavi edebileceği yönünde belirtiler var.[32]
Sızdıran bağırsak sendromu
Sızdıran bağırsak sendromu olarak adlandırılan bir tıbbi durum, bazı alternatif tıp ve beslenme uzmanları başta olmak üzere bazı sağlık pratisyenleri tarafından, bağırsak duvarının normal işleyişini restore etmenin birçok sistemik sağlık sorununu iyileştirebileceği iddiasıyla popüler hale gelmiştir. Bu iddia ispat edilememistir. "sızdıran bağırsak sendromu" için yapılan tedavilerin - besin takviyeleri, probiyotikler,[9] bitkisel ilaçlar, glütensiz yiyecekler veya düşük FODMAP, düşük şeker veya antifungal diyetler - faydalı oldukları iddia edilen sorunların çoğu için faydalı etkileri iddialarının kanıtları yoktur.[18]
Ayrıca bakınız
Kaynakça
- M. Campieri; C. Fiocchi; S.B. Hanauer (31 Mart 2002). Inflammatory Bowel Disease: A Clinical Case Approach to Pathophysiology, Diagnosis, and Treatment. Springer. s. 7. ISBN 978-0-7923-8772-5. 21 Eylül 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Kasım 2019.
- Thoma YM, Anderson JM, Turner JR (2012). Johnson LR (Ed.). Tight Junctions and the Intestinal Barrier. Physiology of the Gastrointestinal Tract. 1. Academic Press. ss. 1043-. ISBN 978-0-12-382027-3. 21 Eylül 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ekim 2019.
- Fasano, A. (Şubat 2012). "Leaky Gut and Autoimmune Diseases". Clinical Reviews in Allergy & Immunology (Review). 42 (1). ss. 71-78. doi:10.1007/s12016-011-8291-x. PMID 22109896.
- Groschwitz, Katherine R.; Hogan, Simon P. (1 Temmuz 2009). "Intestinal Barrier Function: Molecular Regulation and Disease Pathogenesis". Journal of Allergy and Clinical Immunology. 124 (1). ss. 3-22. doi:10.1016/j.jaci.2009.05.038. PMC 4266989 $2. PMID 19560575.
- Rao, Jaladanki N.; Wang, Jian-Ying (1 Ocak 2010). "Intestinal Architecture and Development" (İngilizce). Morgan & Claypool Life Sciences.
- Khan, Niamat; Asif, Abdul R. (1 Ocak 2015). "Transcriptional Regulators of Claudins in Epithelial Tight Junctions". Mediators of Inflammation. Cilt 2015. s. 219843. doi:10.1155/2015/219843. PMC 4407569 $2. PMID 25948882.
- Näslund, Erik; Hellström, Per M. (10 Eylül 2007). "Appetite signaling: from gut peptides and enteric nerves to brain". Physiology & Behavior. 92 (1–2). ss. 256-262. doi:10.1016/j.physbeh.2007.05.017. PMID 17582445.
- Fasano A (Jan 2011). "Zonulin and its regulation of intestinal barrier function: the biological door to inflammation, autoimmunity, and cancer". Physiological Reviews (Review). 91 (1). ss. 151-75. CiteSeerX 10.1.1.653.3967 $2. doi:10.1152/physrev.00003.2008. PMID 21248165.
- Rapin JR, Wiernsperger N (2010). "Possible links between intestinal permeability and food processing: A potential therapeutic niche for glutamine". Clinics (Review). 65 (6). ss. 635-43. doi:10.1590/S1807-59322010000600012. PMC 2898551 $2. PMID 20613941.
- Leonard MM, Sapone A, Catassi C, Fasano A (2017). "Celiac Disease and Nonceliac Gluten Sensitivity: A Review". JAMA (Review). 318 (7). ss. 647-656. doi:10.1001/jama.2017.9730. PMID 28810029.
Previous studies have shown that gliadin can cause an immediate and transient increase in gut permeability. This permeating effect is secondary to the binding of specific undigestible gliadin fragments to the CXCR3 chemokine receptor with subsequent release of zonulin, a modulator of intercellular tight junctions. This process takes place in all individuals who ingest gluten. For the majority, these events do not lead to abnormal consequences. However, these same events can lead to an inflammatory process in genetically predisposed individuals when the immunologic surveillance system mistakenly recognizes gluten as a pathogen.
- O'Hara, JR; Buret, AG (2008). "Mechanisms of intestinal tight junctional disruption during infection". Frontiers in Bioscience. 13 (13). ss. 7008-21. doi:10.2741/3206. PMID 18508712.
- Suzuki, Takuya (1 Şubat 2013). "Regulation of intestinal epithelial permeability by tight junctions". Cellular and Molecular Life Sciences (İngilizce). 70 (4). ss. 631-659. doi:10.1007/s00018-012-1070-x. PMID 22782113.
- Maslennikov, R; Pavlov, C; Ivashkin, V (Kasım 2018). "Small intestinal bacterial overgrowth in cirrhosis: systematic review and meta-analysis". Hepatology international. 12 (6). ss. 567-576. doi:10.1007/s12072-018-9898-2. PMID 30284684.
- Márquez, M; Fernández Gutiérrez, Del Álamo C; Girón-González, JA (2016). "Gut epithelial barrier dysfunction in human immunodeficiency virus-hepatitis C virus coinfected patients: Influence on innate and acquired immunity". World Journal of Gastroenterology. 22 (4). ss. 1433-48. doi:10.3748/wjg.v22.i4.1433. PMC 4721978 $2. PMID 26819512.
- Bischoff SC, Barbara G, Buurman W, Ockhuizen T, Schulzke JD, Serino M, Tilg H, Watson A, Wells JM (18 Kasım 2014). "Intestinal permeability--a new target for disease prevention and therapy". BMC Gastroenterology (Review). Cilt 14. s. 189. doi:10.1186/s12876-014-0189-7. PMC 4253991 $2. PMID 25407511.
- Viggiano D, Ianiro G, Vanella G, Bibbò S, Bruno G, Simeone G, ve diğerleri. (2015). "Gut barrier in health and disease: focus on childhood" (PDF). European Review for Medical and Pharmacological Sciences. 19 (6). ss. 1077-85. PMID 25855935. 10 Ağustos 2017 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 3 Kasım 2019.
- Yeoh N, Burton JP, Suppiah P, Reid G, Stebbings S (Mar 2013). "The role of the microbiome in rheumatic diseases". Current Rheumatology Reports (Review). 15 (3). s. 314. doi:10.1007/s11926-012-0314-y. PMID 23378145.
- "Leaky gut syndrome". NHS Choices. 26 Şubat 2015. 31 Ekim 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Ağustos 2016.
- Yarandi SS, Peterson DA, Treisman GJ, Moran TH, Pasricha PJ (2016). "Modulatory Effects of Gut Microbiota on the Central Nervous System: How Gut Could Play a Role in Neuropsychiatric Health and Diseases". Journal of Neurogastroenterology and Motility (Review). 22 (2). ss. 201-12. doi:10.5056/jnm15146. PMC 4819858 $2. PMID 27032544.
In patients with schizophrenia, there are increased intestinal permeability and change in intestinal function
- Severance EG, Yolken RH, Eaton WW (2016). "Autoimmune diseases, gastrointestinal disorders and the microbiome in schizophrenia: more than a gut feeling". Schizophrenia Research (Review). 176 (1). ss. 23-35. doi:10.1016/j.schres.2014.06.027. PMC 4294997 $2. PMID 25034760.
- Teixeira TF, Collado MC, Ferreira CL, Bressan J, Peluzio Mdo C (Eylül 2012). "Potential mechanisms for the emerging link between obesity and increased intestinal permeability". Nutrition Research (Review). 32 (9). ss. 637-47. doi:10.1016/j.nutres.2012.07.003. PMID 23084636.
- Festi D, Schiumerini R, Eusebi LH, Marasco G, Taddia M, Colecchia A (Kasım 2014). "Gut microbiota and metabolic syndrome". World Journal of Gastroenterology (Review). 20 (43). ss. 16079-16094. doi:10.3748/wjg.v20.i43.16079. PMC 4239493 $2. PMID 25473159.
- Kiefer, D; Ali-Akbarian, L (2004). "A brief evidence-based review of two gastrointestinal illnesses: Irritable bowel and leaky gut syndromes". Alternative Therapies in Health and Medicine. 10 (3). ss. 22-30; quiz 31, 92. PMID 15154150.
- Rao M, Gershon MD (Eylül 2016). "The bowel and beyond: the enteric nervous system in neurological disorders". Nature Reviews Gastroenterology & Hepatology (Review). 13 (9). ss. 517-28. doi:10.1038/nrgastro.2016.107. PMC 5005185 $2. PMID 27435372.
- Heyman M, ve diğerleri. (Sep 2012). "Intestinal permeability in coeliac disease: insight into mechanisms and relevance to pathogenesis". Gut (Review). 61 (9). ss. 1355-64. doi:10.1136/gutjnl-2011-300327. PMID 21890812.
Changes in intestinal paracellular and transcellular permeability appear secondary to the abnormal immune reaction induced by gluten. Gliadin was suggested to increase junction permeability to small molecules through the release of prehaptoglobin-2. Environmental triggers of CD other than gliadin may also promote changes in permeability. Intestinal infection and iron deficiency can stimulate the expression of the transferrin receptor (TfR) CD71 in enterocytes. ... Once established, the alterations in intestinal permeability, notably the retro-transport of IgA-gliadin peptides, might self-sustain the inflammatory immune responses and perpetuate a vicious circle.
- Khaleghi, Shahryar; Ju, Josephine M.; Lamba, Abhinav; Murray, Joseph A. (Jan 2016). "The potential utility of tight junction regulation in celiac disease: focus on larazotide acetate". Therapeutic Advances in Gastroenterology (Review. Research Support, N.I.H., Extramural). 9 (1). ss. 37-49. doi:10.1177/1756283X15616576. PMC 4699279 $2. PMID 26770266.
- Fasano A (2012). "Intestinal permeability and its regulation by zonulin: diagnostic and therapeutic implications". Clinical Gastroenterology and Hepatology (Review). 10 (10). ss. 1096-100. doi:10.1016/j.cgh.2012.08.012. PMC 3458511 $2. PMID 22902773.
- Akobeng, AK; Elawad, M; Gordon, M (8 Şubat 2016). "Glutamine for induction of remission in Crohn's disease" (PDF). Cochrane Database of Systematic Reviews. Cilt 2. ss. CD007348. doi:10.1002/14651858.CD007348.pub2. PMID 26853855. 22 Eylül 2017 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 3 Kasım 2019.
- Lopetuso LR, Scaldaferri F, Bruno G, Petito V, Franceschi F, Gasbarrini A (2015). "The therapeutic management of gut barrier leaking: the emerging role for mucosal barrier protectors". European Review for Medical and Pharmacological Sciences. 19 (6). ss. 1068-1076. PMID 25855934. 22 Nisan 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Kasım 2019.
- Ganesan K, Chung SK, Vanamala J, Xu B (2018). "Causal Relationship between Diet-Induced Gut Microbiota Changes and Diabetes: A Novel Strategy to Transplant Faecalibacterium prausnitzii in Preventing Diabetes". International Journal of Molecular Sciences. 19 (12). ss. E3720. doi:10.3390/ijms19123720. PMC 6320976 $2. PMID 30467295.
- Crespo Pérez L, ve diğerleri. (Jan 2012). "Non-dietary therapeutic clinical trials in coeliac disease". European Journal of Internal Medicine (Review). 23 (1). ss. 9-14. doi:10.1016/j.ejim.2011.08.030. PMID 22153524.
- https://www.youtube.com/watch?v=nDPM8o9jcFA 26 Kasım 2019 tarihinde Wayback Machine sitesinde arşivlendi. Dr. Zsófia Clemens — “Intestinal Permeability in Autoimmune Diseases and Cancer"