Limonene
Limonen renksiz bir sıvıdır alifatik hidrokarbon döngüsel monoterpen olarak sınıflandırılır ve turunçgillerin meyve kabuklarının içindeki yağın ana bileşenidir.[1] D-izomeri doğada daha çok portakal kokusu olarak ortaya çıkan gıda üretiminde kullanılan bir tatlandırıcıdır.[1][2] Ayrıca kimyasal sentezde öncü ila carvone ve temizlik ürünlerinde yenilenebilir bazlı çözücü olarak da kullanılır.[1] Daha az yaygın olan L- izomer nane yağlarında bulunur ve çam, terebentin benzeri bir kokuya sahiptir.[1] Bileşik iğne yapraklıların reçinesinde özellikle Pinaceae ve portakal yağında bulunan ana uçucu monoterpenlerden biridir. Limonene adını Fransızca lemondan ("limon") alır.[3] Limonen bir kiral molekülüdür ve biyolojik kaynaklar bir enantiyomer üretir: ana endüstriyel kaynak narenciye (R)-enantiyomer olan D-limonene((+)- limonen) içerir.[4] D-Limonen ticari olarak iki ana yöntemle turunçgillerden elde edilir: santrifüjlü ayırma veya buharla damıtma.
| Bu sayfa, İngilizce Lemonene maddesinden çevrilmektedir. Siz de yardım etmek istiyorsanız ya da çeviri yarıda kalmışsa, çalışmaya katılan kişilerle veya çeviri grubu ile iletişime geçip, sayfanın durumunu onlara sorabilirsiniz. Sayfanın geçmişine baktığınızda, sayfa üzerinde çalışma yapanları görebilirsiniz. |
Şablon:Kimyakutu Identifiers
| Limonene | |
|---|---|
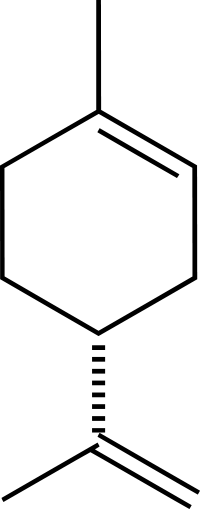 | |
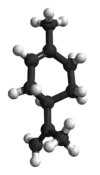 (R)-izomerin top ve çubuk modeli | |
 | |
| Özellikler | |
| Kimyasal formül | C10H16 |
| Molekül kütlesi | 136,23 g mol−1 |
| Görünüm | renksizden soluk-sarı sıvıya |
| Koku | Portakal |
| Yoğunluk | 0.8411 g/cm3 |
| Erime noktası |
-74.35 |
| Kaynama noktası |
176 |
| Termokimya | |
Standart yanma entalpisi (ΔcH |
−6.128 MJ mol−1 |
| Tehlikeler | |
| GHS İşaret sözcüğü | Tehlike |
| NFPA 704 |
 2
3
0
|
| Parlama noktası | 50 |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Kimyasal reaksiyonlar
Limonen nispeten kararlı bir mono terpen 'dir ve yüksek sıcaklıklarda izopren oluşturmak için çatlamasına rağmen ayrışma olmaksızın damıtılabilir.[5] Carveol, carvone ve limonen oksit üretmek için nemli havada kolayca oksitlenir.[1][6] Kükürt ile "p" - simen şeklinde dehidrojenasyona uğrar.[7]
Kaynakça
- "D-Limonene". PubChem Compound Database. National Center for Biotechnology Information, US National Library of Medicine. 2017. 18 Mayıs 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Aralık 2017.
- Merriam-Webster's dictionary entry for "limonene". Accessedon 16 March 2020.
- Simonsen, J. L. (1947). The Terpenes. 1 (2nd bas.). Cambridge University Press. OCLC 477048261.
- Pakdel, H. (2001). "Production of DL-limonene by vacuum pyrolysis of used tires". Journal of Analytical and Applied Pyrolysis. 57: 91-107. doi:10.1016/S0165-2370(00)00136-4.
- Karlberg, Ann-Therese; Magnusson, Kerstin; Nilsson, Ulrika (1992). "Air oxidation of D-limonene (the citrus solvent) creates potent allergens". Contact Dermatitis. 26 (5): 332-340. doi:10.1111/j.1600-0536.1992.tb00129.x. PMID 1395597.
- Weitkamp, A. W. (1959). "I. The Action of Sulfur on Terpenes. The Limonene Sulfides". Journal of the American Chemical Society. 81 (13): 3430-3434. doi:10.1021/ja01522a069.