Toll benzeri reseptör
Toll benzeri reseptör ya da almaç (TLR, Toll Like Receptor), mikroplardan kaynaklanan, yapısal olarak korunmuş moleküller deri veya bağırsak mukozası gibi fiziki bariyerleri aştığında, bu molekülleri tanıyan tek membran boyunca uzanmış, katalitik-olmayan reseptörlerin bir sınıfıdır. Bu yapıların doğuştan gelen bağışıklık sisteminde anahtar rol oynadıkları düşünülmektedir.

İsimlerini Drosophilada 1985'te Christiane Nüsslein-Volhard tarafından keşfedilen Tolla benzerliklerinden dolayı alırlar.[1]
Çeşitlilik
TLRler, kalıp tanıma reseptörlerinin (PRR) bir çeşididir ve patojenlerle geniş ölçüde paylaşılmış fakat ev sahibi moleküllerinden ayırtedilebilen molekülleri, yani tamamiyle; patojenlerle ilişkilendirilmiş molekül kalıpları (PAMPlar) olarak adlandırılan molekülleri tanırlar.
Bir reseptör üst ailesi olan interlökin-1 reseptörleri ile yaygın olarak TIR (Toll-IL-1 reseptör) diye adlandırılan alanı oluştururlar.
TIR alanının 3 alt grubu bulunmaktadır:
- Alt grup TIR 1 bölgelerini içeren proteinler; makrofajlar, monositler, dendritik hücreler tarafından üretilen interlökin için reseptörlerdir ve hepsi ekstraselüler immünoglobulin sahaları bulundururlar.
- Proteinin alt grup TIR 2 bölgesini içerenleri klasik TLRlerdir, ve mikrobiyal kökenli molekülleri direkt ya da indirekt olarak bağlarlar.
- TIR 3 bölgelerini içeren proteinlerin 3. bir alt grubu; proteinlerin 1 ve 2. alt grupları arasında sinyallemeye aracılık eden ve sadece sitosölik adaptör proteinlerden oluşur.
TLR'ler, omurgasızlarda da, omurgalılarda bulundukları gibi bulunurlar.
TLR'lerin bakteriler ve bitkilerde ve bitkiler aleminde enfeksiyon karşısında ev sahibinin savunmasında gerekli olarak bilinmektedirler. TLR'ler, bu suretle eski zamanlardan beri bağışıklık sisteminin korunmuş bileşenleri gibi görünmektedir.
Keşifleri
Enfeksiyon hastalıklarının nedenleri olan mikroplar ilk tanındıklarında, çok çekirdekli canlıların sistemleri enfekte olduğuklarını anlayabilir ve onları hemen temizler, yani, sistem mikroplara özgül molekülleri de tanıyabilmektedir.
Vücut dilinde, anahtarların, moleküller ve onların reseptörleri olduğu, geçen yüzyıldan beri yapılan aramalarla doğrulanmıştır. 100 yıldan daha önce Robert Koch'un bir öğrencisi olan Richard Pfeiffer, "endotoksin" terimini, Gram negatif bakterilerin, model organizmalarda ateşlenmeyi ve şoku harekete geçiren ürününü anlatmak için kullanmıştır. Bunu izleyen on yılda, endotoksin kimyasal olarak karekterize edilmiş ve çoğu Gram negatif bakterilerice üretilen bir lipopolisakkarid (LPS) olarak tanımlanmıştr. Diğer moleküllerin (bakteriyal lipopeptidler, flagellin ve metillenmemiş DNA), sırayla, normalde koruma yapan ev sahibi yanıtlarını harekete geçirdiği gösterilmiştir. Bununla beraber, bu yanıtlar eğer çok daha uzun ya da kuvvetli olduğunda zararlı olabilmektedirler.
Bu, enfeksiyon sırasında ev sahibinin alarm konumuna geçmesini sağlayabilen ve yıllarca kolayca sağlanabilen bazı moleküller için reseptörlerin bulunabileceği şeklinde mantıken izlenmiştir.
Toll benzeri reseptörlerin günümüzde, bağışıklık sisteminin mikrobiyal enfeksiyonlara karşı durmasında anahtar rolü oynayan moleküller olduğu sayılmaktadır. TLR adını, ilk defa Drosophila melanogasterde tanımlanan bir reseptöre, başlangıçta bu canlı için gelişimimsel fonksiyonu için bilinen, "Toll geni"ne olan benzerliğinden dolayı almıştır. Toll, 1996'da, Jules A. Hoffmann ve çalışma arkadaşları tarafından [2], sineğin mantar enfeksiyonu karşısında, antimikrobiyal peptidleri sentezlemesini etkinleştirerek temel bir rolü başardığında bulunmuştur.
Kayıtlara geçmiş ilk insan Toll benzeri reseptörü Nomura ve çalışma arkadaşları tarafından [3] 1994'te tanımlanmış, Taguchi ve çalışma arkadaşları tarafından 1996'da bir kromozom üzerinde haritalanmıştır[4]. Toll'un Drosophila'nın bağışıklık sistemi üzerindeki etkisi bilinmiyorken, şu an TLR1 olarak bilinen TIL'ın memeli gelişimine katılabildiği farzedilmiştir. Bununla beraber, 1991'de (TIL'ın keşfinden önce), memelilerin bağışıklık fonksiyonunda açıkça bir rol alan, interlökin-1 (IL-1) reseptörünün, Drosophila Toll'una kökendeş (homolog); her iki molekülünde sitoplazmik parçaları epeyce benzeyen bir molekülü olarak incelenmiştir [5].
1997'de, Charles Janeway ve Ruslan Medzhitov bugün TLR4 olarak bilinen bir Toll benzeri reseptörünün, antikorlar kullanılarak yapay bir biçimde bağlandığında, uygun bir bağışıklık yanıtını başlatmak için gerekli olan belirli genlerin etkinleştirilmesine yol açtığını kanıtlamışlardır [6]. Fakat, TLR'lerin bu eylemin uyanışındaki fonksiyonu bilinmeyen olarak devam etmektedir ve özellikle memeli TLR'leri için hiçbir bir bağlayıcı (ligand) tanımlanamamıştır.
TLR'lerin fonksiyonları Bruce Beutler ve çalışma arkadaşları tarafından keşfedilmiştir [7]. Bu araştırmacılar, farelerin TLR4 fonksiyonlarını mutasyonlara sahip LPS'e cevap veremediklerini pozisyonal klonlamayı kullanarak göstermişlerdir. Bu, TLR4'ün LPS reseptörünün anahtar bir bileşeni olduğunu göstermiş ve kuvvetli bir şekilde diğer Toll-benzeri reseptörlerin, yukarıda bahsi geçenler gibi, mikrop imzalı molekülleri bulabileceğini ileri sürmüştür. Sırayla diğer TLR genleri de, gen hedeflenmesiyle farelerde, çoğunlukla Shizuo Akira ve çalışma arkadaşlarının laboratuvarında çıkarılmıştır. Her TLR'ın mikrobiyal kaynaklı moleküllerden ayrı bir koleksiyonu aradığına ve enfeksiyonlarda sinyalleme yaptığına inanılmaktadır.
Genişletilmiş aile
Çoğu memeli türünde on ila on beş arasında Toll benzeri reseptör tipinin bulunduğu tahmin edilmektedir. On üçüncü TLR (basitçe TLR1'den TLR13'e isimlendirilmişlerdir) fareler ve insanlarda birlikte tanımlanmışlardır, bunların bazı eşit formları diğer memeli türlerinde de bulunmuştur [8][9][10].
Bununla beraber, TLR'lerin insanlarda bulunan belirli eşit formları memelilerin hepsinde bulunmaz. Örneğin insanlarda TLR10'un benzeri (analoğu) olan bir protein için gen kodlama farelerde de sunulur, fakat bazı noktaları retrovirüsler tarafından geçmişte hasara uğratılmış gibi görünmektedir. Diğer taraftan, insanlarda bulunmayan TLR11, 12 ve 13 farelerde (ifade) eksprese edilir. Diğer memeliler insanlarda bulunmayan TLR'leri ifade edebilirler. Bu, insanlardaki doğuştan gelen bağışıklıkta, model canlı olarak kullanılan deney hayvanları kullanımını karmaşıklaştırabilir.
Bağlayıcılar
Toll benzeri reseptörler (ve diğer doğuştan gelen bağışıklık reseptörleri) özgüllüklerinden dolayı evrim sürecinde kolayca değişemezler, bu reseptörler tehditlerle (patojenler ya da hücre stresi gibi) ilişkilendirilen molekülleri daima tanırlar ve bu unsurlara yüksek özgüllük gösterirler (kendi molekülleriyle karşılaştıklarında yanılmazlar). Bu gerekliliğe uyan patojenle ilişkili moleküller genellikle patojenin işleviyle tehlikelidirler ve mutasyonlarla silinemez ya da değiştirilemezler, bu özellikleriyle "evrimsel olarak korunmuş" sayılırlar. Patojenlerde korunan özellikler; bakterilerde hücre yüzeyi lipopolisakkaritleri (LPS), lipoproteinler, lipopeptidler, ve lipoarabinomannan; bakteriyal kamçıdan flagellin gibi proteinler; virüslerin çift zincirli RNA'sı veya bakteriyal ve viral DNA'nın metillenmemiş CpG adaları ve diğer RNA ve DNA'lardır.
TLR'lerin çoğu için bağlayıcı tanıma özgüllüğü, günümüzde gen-hedeflenmesi (ya da "gen değiş-tokuşu") olarak bilinen bir teknikle, farelerde yalnızca seçilen genlerin silinmesiyle saptanmıştır [11][12]. TLR bağlayıcıları için aşağıdaki özet tablosuna bakınız.
Endojen bağlayıcılar
TLR etkinliğince uyarılan stereotipik yangı yanıtı, TLRlerin endojen aktivatörlerinin kendine bağışık hastalıklarda payı olduğu kurgularını beraberinde getirmiştir.
TLRlerin ev sahibinin, (kan pıhtılaşmasyıla ilişkili) fibrojen ve ısı şoku proteinleri (HSPler) ve konak DNAsını da kapsayan moleküllerine bağlandığından şüphelenilmektedir.
Sinyalleme
TLRlerin dimerler olarak işlevleri olduğuna inanılmaktadır. Çoğu TLR homodimer olarak fonksiyon gösterse de, TLR2, TLR1 ya da TLR6 ile heterodimerleri oluşturur, her dimer farklı bir bağlayıcı (ligand) özgüllündedir. TLRler ayrıca, tam bağlanma duyarlılığı için, TLR4'ün LPS'yi tanıması durumunda MD-2'ye ihtiyaç duyması durumunda olduğu gibi, diğer yardımcı-reseptörlere bağlı olabilirler.
CD14 ve LPS Bağlayıcı Protein (LBP) LPS'nin MD-2'ye sunumu kolaylaştırmakla bilinmektedir.
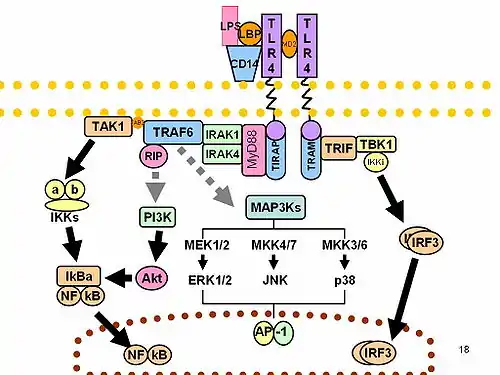
TLR sinyallemede aracılık yapan aracı proteinler ve kinazlar ayrıca hedeflenirler.
Ek olarak, Bruce Beutler'in laboratuvarında ENU ile birlikte rastgele eşey hücre öncülü mutagenezi, TLR sinyalleme yollarnı çözmek için kullanılmıştır.
TLRler etkinleştirildiklerinde bir sinyali başlatmak için aracı molekülleri hücrelerin sitoplazmaları içerisinden çağırırlar. Sinyallemeyle ilişkili olarak dört aracı molekül bilinmektedir. Bu proteinler MyD88, Tirap (Mal diye de bilinir), Trif, ve Tram'dır [13][14][15]. Bu aracılar hücre içindeki diğer molekülleri, sinyali yükselten belli protein kinazlarla (IRAK1, IRAK4, TBK1 ve IKKi) etkinleştiriler ve nihayetinde yangı yanıtını planlayan genlerin baskılanmasına ya da göreve getirilmesine öncülük ederler. Sonuç olarak, TLR sinyallemesiyle binlerce gen etkinleştirilir; TLRler, gen düzenlenmesi için en güçlü ve önemli kapılardan birini oluşturmaktadırlar.
Memelilerde bilinen Toll-benzeri reseptörlerin özeti
Toll-benzeri reseptörler, canlıların ya da yapıların farklı tiplerinde yerleşim gösteren farklı bağlayıcılar tarafından bağlanır ve etkin hale getirilirler. Ayrıca, etkinleşmeye yanıt verecek farklı aracıları bulundururlar ve bazen hücre yüzeyinde, kimi zamanda iç hücre bölmelerinde yerleşim gösterirler. Dahası, lökositlerin ve diğer hücre farklı tiplerince ifade edilirler:
| Reseptör | Bağlayıcı(lar) [16] | Bağlayıcı bölgesi [16] | Aracı(lar) | Yer | Hüvre tipleri[16] |
|---|---|---|---|---|---|
| TLR 1 | multipl triaçil lipopeptideler | Bakteri | MyD88/MAL | hücre yüzeyi |
|
| TLR 2 | multipl glikolipidler | Bakteri | MyD88/MAL | hücre yüzeyi |
|
| multipl lipopeptideler | Bakteri | ||||
| multipl lipoprotein | Bakteri | ||||
| lipoteikoik asit | Bakteri | ||||
| peptidoglikan | Gram pozitif bakteri | ||||
| HSP70 | Konak hücreler | ||||
| zimosan | Mantar | ||||
| Çok sayıda diğer | |||||
| TLR 3 | çift zincirli RNA, poli I:C | virüsler | TRIF | hücre kompartımanı |
|
| TLR 4 | lipopolisakkarid | Gram negatif bakteri | MyD88/MAL/TRIF/TRAM | hücre yüzeyi |
|
| bazı ısı şoku proteinleri | Bakteri ve konak hücreler | ||||
| fibrinojen | konak hücreler | ||||
| heparan sülfat parçaları | konak hücreler | ||||
| hyalüronik asit parçaları | konak hücreler | ||||
| Çok sayıda diğer | |||||
| TLR 5 | flagellin | Bakteri | MyD88 | hücre yüzeyi |
|
| TLR 6 | multipl diaçil lipopeptidler | Mycoplasma | MyD88/MAL | hücre yüzeyi |
|
| TLR 7 | imidazoquinolin | küçük sentetik bileşenler | MyD88 | hücre kompartımanı |
|
| loksoribin (bir guanozin benzeri) | |||||
| bropirimin | |||||
| tek-zincirli RNA | |||||
| TLR 8 | küçük sentetik bileşenler; tek-zincirli RNA | MyD88 | hücre kompartımanı |
| |
| TLR 9 | metillenmemiş CpG DNA | Bakteri | MyD88 | hücre kompartımanı |
|
| TLR 10 | bilinmiyor | bilinmiyor | bilinmiyor | cell surface |
|
| TLR 11 | Profilin | Uropatojenik bakteri | MyD88 | hücre yüzeyi |
|
| TLR 12 | bilinmiyor | bilinmiyor | ? | ||
| TLR 13 | bilinmiyor | bilinmiyor | ? |
Etkinleştirilme ve etkileri
Mikrobiyal kaynaklı bazı bağlayıcıların etkinleştirilmesini izleyen bazı reaksiyonlar görülebilir. Bağışıklık hücreleri yangıyı tetikleyen "sitokin" denilen sinyal faktörleri üretebilirler. Bakteriyal faktör durumunda, patojen fagosite edilir ve sindirilir, antijeni de CD4+ T hücrelerine gönderilir. Viral faktör durumunda, enfekte hücre protein sentezini kapatır ve hücreyi programlanmış hücre ölümüne (apoptozise) sevkeder. Bağışıklık hücreleri bir virüsleri bulduklarında interferonlar gibi anti-viral faktörleri salarlar.
Doğuştan gelen bağışıklığın fonkisyonlarından sorumlu, bu bağışıklığın en sonunda tanımlanan reseptörleri olan Toll benzeri reseptörler uzun yıllar çalışılmışlardır. İlginç olan, TLR'ler sadece, sitokin üretimi ve mikroplara karşı hücresel yanıtın tkinleştirilmesiyle ilişkili ve mikroorganizmaların adezyon ve fagositozunda önemli bir rol oynamaz görünmektedirler.
İlaç etkileşimleri
Başlıca, dermatolojide kullanılan Imiquimod ve ardılı R848, TLR7 ve TLR8 için bağlayıcıdırlar [18].
Kaynakça
- Hansson GK, Edfeldt K (2005). "Toll to be paid at the gateway to the vessel wall". Arterioscler. Thromb. Vasc. Biol. 25 (6). ss. 1085-7. doi:10.1161/01.ATV.0000168894.43759.47. PMID 15923538. 11 Ekim 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 10 Mayıs 2008.
- Lemaitre,B., Nicolas,E., Michaut,L., Reichhart,J.M., and Hoffmann,J.A. 1996. The dorsoventral regulatory gene cassette spatzle/Toll/cactus controls the potent antifungal response in Drosophila adults. Cell 86:973-983.
- Nomura,N., Miyajima,N., Sazuka,T., Tanaka,A., Kawarabayasi,Y., Sato,S., Nagase,T., Seki,N., Ishikawa,K., and Tabata,S. 1994. Prediction of the coding sequences of unidentified human genes. I. The coding sequences of 40 new genes (KIAA0001-KIAA0040) deduced by analysis of randomly sampled cDNA clones from human immature myeloid cell line KG-1. DNA Res. 1:27-35
- Taguchi,T., Mitcham,J.L., Dower,S.K., Sims,J.E., and Testa,J.R. 1996. Chromosomal localization of TIL, a gene encoding a protein related to the Drosophila transmembrane receptor Toll, to human chromosome 4p14. Genom. 32:486-488
- Gay NJ, Keith FJ. Drosophila Toll and IL-1 receptor. Nature. 1991 May 30;351(6325):355-6.
- Medzhitov,R., Preston-Hurlburt,P., and Janeway,C.A., Jr. 1997. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature 388:394-397.
- Poltorak A, He X, Smirnova I, Liu MY, Van Huffel C, Du X, Birdwell D, Alejos E, Silva M, Galanos C, Freudenberg M, Ricciardi-Castagnoli P, Layton B, Beutler B. Science. 1998 Dec 11;282(5396):2085-8.
- Du,X., Poltorak,A., Wei,Y., and Beutler,B. 2000. Three novel mammalian toll-like receptors: gene structure, expression, and evolution. Eur. Cytokine Netw. 11:362-371.
- Chuang,T.H., and Ulevitch,R.J. 2000. Cloning and characterization of a sub-family of human toll-like receptors: hTLR7, hTLR8 and hTLR9. Eur. Cytokine Netw. 11:372-378.
- Tabeta,K., Georgel,P., Janssen,E., Du,X., Hoebe,K., Crozat,K., Mudd,S., Shamel,L., Sovath,S., Goode,J. et al 2004. Toll-like receptors 9 and 3 as essential components of innate immune defense against mouse cytomegalovirus infection. Proc. Natl Acad. Sci. U. S. A 101:3516-3521.
- Hoebe,K., Du,X., Georgel,P., Janssen,E., Tabeta,K., Kim,S.O., Goode,J., Lin,P., Mann,N., Mudd,S. et al 2003. Identification of Lps2 as a key transducer of MyD88-independent TIR signaling. Nature 424:743-748.
- Hemmi,H., Takeuchi,O., Kawai,T., Kaisho,T., Sato,S., Sanjo,H., Matsumoto,M., Hoshino,K., Wagner,H., Takeda,K. et al 2000. A Toll-like receptor recognizes bacterial DNA. Nature 408:740-745.
- Yamamoto,M., Sato,S., Hemmi,H., Hoshino,K., Kaisho,T., Sanjo,H., Takeuchi,O., Sugiyama,M., Okabe,M., Takeda,K. et al 2003. Role of adapter TRIF in the MyD88-independent Toll-like receptor signaling pathway. Science 301:640-643.
- Yamamoto,M., Sato,S., Hemmi,H., Uematsu,S., Hoshino,K., Kaisho,T., Takeuchi,O., Takeda,K., and Akira,S. 2003. TRAM is specifically involved in the Toll-like receptor 4-mediated MyD88-independent signaling pathway. Nat. Immunol. 4:1144-1150.
- Yamamoto,M., Sato,S., Hemmi,H., Sanjo,H., Uematsu,S., Kaisho,T., Hoshino,K., Takeuchi,O., Kobayashi,M., Fujita,T. et al 2002. Essential role for TIRAP in activation of the signalling cascade shared by TLR2 and TLR4. Nature 420:324-329.
- Unless else specified in boxes then ref is: Lippincott's Illustrated Reviews: Immunology. Paperback: 384 pages. Publisher: Lippincott Williams & Wilkins; (July 1, 2007). Language: English. ISBN 0781795435. ISBN 978-0781795432. Page 17
- Sallusto F, Lanzavecchia A (2002). "The instructive role of dendritic cells on T-cell responses". Arthritis Res. Cilt 4 Suppl 3. ss. S127-32. PMID 12110131.
- Peter Fritsch: "Dermatologie und Venerologie" (German), 2nd ed. 2004, Springer ,ISBN 3-540-00332-0