Termodinamik
Termodinamik ısı, iş, sıcaklık ve enerji arasındaki ilişki ile ilgilenen bilim dalıdır.[1] Basit bir ifadeyle termodinamik, enerjinin bir yerden başka bir yere ve bir biçimden başka bir biçime transferi ile ilgilenir.[2] Bu süreçteki anahtar kavram, ısının, belirli bir mekanik işe denk gelen bir enerji biçimi olmasıdır.[2]
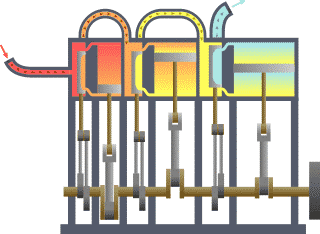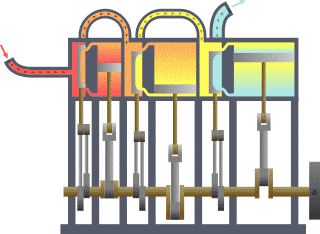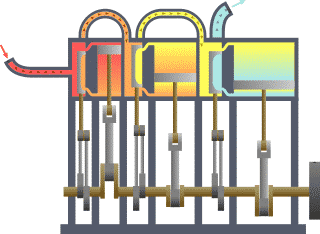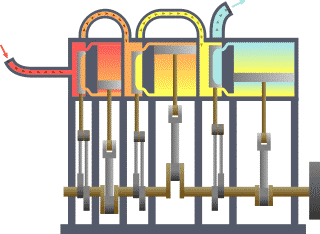
Termodinamik kavramı Yunanca Modern Yunanca: thermos (ısı) ve Modern Yunanca: dynamic (enerji) kelimelerinden türetilmiştir. Bazı Türkçe kaynaklarda ısıl devingi olarak da geçer. Enerji, ısı, iş, entropi ve ekserji gibi fiziksel kavramlarla ilgilenir. Termodinamik yasalarının istatistiksel mekanikten türetilebileceği gösterilmiştir.

Termodinamik her ne kadar sistemlerin madde ve/veya enerji alış-verişiyle ilgilense de, bu işlemlerin hızıyla ilgilenmez. Bundan dolayı aslında termodinamik denilirken, denge termodinamiği kastedilir. Bu yüzden termodinamiğin ana kavramlarından biri "quasi-statik" (yarı-durağan) adı verilen, idealize edilmiş "sonsuz yavaşlıkta" olaylardır. Zamana bağlı termodinamik olaylarla, denge halinde olmayan termodinamik ilgilenir.
Termodinamik yasaları çok genel bir geçerliliğe sahiptirler ve karşılıklı etkileşimlerin ayrıntılarına veya incelenen sistemin özelliklerine bağlı olarak değişmezler. Yani bir sistemin sadece madde veya enerji giriş-çıkışı bilinse dahi bu sisteme uygulanabilirler.
Termodinamik değişkenler
Bu değişkenler genellikle sistemin ya kendisini ya da çevre koşullarını tarif etmek için kullanılır. En çok kullanılanlar ve simgeleri şunlardır:
- Mekanik değişkenler:
- İstatistiksel değişkenler:
Mekanik değişkenler, temel klasik veya parçacık fiziği tanımlarıyla tarif edilebilirken, istatistiksel değişkenler sadece istatistiksel mekanik tanımlarıyla anlaşılabilir.
Termodinamiğin çoğu uygulamasında, bir ya da daha çok değişken sabit tutulurken, diğer değişkenlerin bunlara göre nasıl değiştiği incelenir ve bu da sistemin matematiksel olarak (n sabit tutulmayan değişkenlerin sayısı olmak üzere) n boyutlu bir uzay olarak tarif edilebileceği anlamına gelir. İstatistiksel mekaniği fizik yasalarıyla birleştirerek, bu değişkenleri birbirleri cinsinden ifade edecek "durum denklemleri" yazılabilir. Bunların en basit ve en önemli olanlarından biri ise ideal gaz yasasıdır.
Bu denklemde R evrensel gaz sabiti'dir. Ayrıca istatistiksel mekanik terimleriyle bu denklem şöyle yazılır:
Bu denklemde de k Boltzmann sabiti'dir.
Termodinamik potansiyeller
Termodinamik değişkenler vasıtasıyla dört tane termodinamik potansiyel tanımlanabilir:
| Sistemin iç enerjisi | ||
| Helmholtz serbest enerjisi | ||
| Gibbs serbest enerjisi | ||
| Entalpi |
Entalpi, özel bir fonksiyondur. Basınç sabit olduğu zaman bize ısıyı verir. Bu dört potansiyelin diferansiyel denklemlerini ve zincirleme türev kuralını kullanarak bu dört potansiyel, değişkenler ve birbirleri cinsinden yazılabilir:
Termodinamik kanunları
Sıfırıncı kanun
İki sistem birbirleri ile etkileşim halinde oldukları halde, durumları değişmeden kalıyorsa bu iki sistem birbirleri ile dengededir denilir. Eğer iki sistem etkileşime açık oldukları halde, aralarında mekanik etkileşimle olan enerji transferi (iş) dışında net enerji transferi (ısı geçişi) yoksa, bu iki sistem birbirleri ile ısıl dengededirler. Sıfırıncı yasa şöyle der:
| « Eğer A ve B sistemleri birbirleri ile ısıl dengede ise, A sistemi ile ısıl dengede olan bir C sistemi, B sistemi ile de ısıl denge durumundadır. » |
Bu denge durumu, sıcaklık olarak tanımlanır. Yani her sıcaklık derecesi, farklı bir denge durumunu temsil eder. Bu durum:
TA=TB=TC şeklinde formülize edilir.
1931 yılında Ralph H. Fowler tarafından tanımlanan bu yasa, temel bir fizik ilkesi olarak karşımıza çıktığından, doğal olarak 1. ve 2. yasalardan önce gelmek zorunluluğu doğmuş ve sıfırıncı yasa adını almıştır.
Bu yasanın uygulanışına örnek olarak termometreler verilebilir. Termometre "üçüncü sistem" olarak kullanılır ve bir sıcaklık ölçeği oluşturulmasına imkân verir.
Birinci kanun
Termodinamiğin birinci yasası "enerjinin korunumu" olarak da bilinir. Bu yasaya göre:
| « Bir sistemin iç enerjisindeki değişim miktarı, o sisteme ilave edilen ısı miktarı ile sistemin çevresine uyguladığı iş arasındaki farka eşittir. » |
Bu durum şöyle gösterilir:
- U2 – U1 = Q – W
Enerji yoktan var edilemez ve yok edilemez sadece bir şekilden diğerine dönüşür. Bir sistemin herhangi bir çevrimi için çevrim sırasında ısı alışverişi ile iş alışverişi aynı birim sisteminde birbirlerine eşit farklı birim sistemlerinde ise birbirlerine orantılı olmak zorundadır. Bu ifadelerin yapılan deneylerle doğruluğu gözlenmiştir fakat ispat edilememektedir. Bütün bu ifadeler matematiksel olarak çok daha kolay ifade edilebilir.
Aşağıdaki formüllerde
- Q = çevrim boyunca net ısı alışverişini
- W = çevrim boyunca net iş alışverişini
göstermektedir. Çevrim de şu şekilde gösterilmiştir:
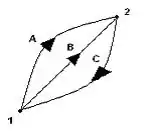
Şimdi bu şekilde sistemin herhangi iki hali görünüyor yani 1 ve 2 nolu noktalar. Hal değişimleri ise A, B, C çizgileriyle sağlansın. Ok yönleri de hal değişimlerinin olacağı yönler. Şimdi hal değişimleri 1A2 ve 1B2 ise 2C1 ilk hale dönülen durumdur. Şimdi çevrimleri kurguluyalım elimizde 1A2C1 ve 1B2C1 çevrimleri var:
- 1A∫2.δ.Q + 2C∫1.δ.Q = 1A∫2.δ.W + 2C∫1.δ.W (1A2C1 çevrimi) (a denklemi)
- 1B∫2.δ.Q + 2C∫1.δ.Q = 1B∫2.δ.W + 2C∫1.δ.W (1B2C1 çevrimi) (b denklemi)
1A2C1 ve 1B2C1 çevrimleri birbirlerine eşittir. Termodinamiğin 1. kanunu uygulandığında a ve b denklemleri ortaya çıkar b denklemi a denkleminden çıkarırsak c denklemi bulunur.
- 1A∫2 (δQ - δW) = 1B∫2( δQ - δW) (c denklemi)
1A2 ve 1B2 aynı haller arasında herhangi iki hal değişimi olduğundan δQ – δW ifadesinin 1-2 noktası arasındaki bütün hal değişimleri için bağımsız olduğu söylenebilir. Bunların farkı nokta fonksiyonudur ve tam diferansiyeldir. Bu sisteme has bir özellik olup sistemin enerjisidir ve E ile gösterilir (E=δQ-δW) sonsuz küçük hal değişimi için bu formülün integrali alınırsa;
- Q1-2 : Sistemin hal değişimindeki ısı alışverişi
- W1-2 : Sistemin hal değişimindeki iş alışverişi
- E1 : Sistemin ilk haldeki enerjisi ve
- E2 : Sistemin son haldeki enerjisi
olmak üzere;
- Q1-2 – W1-2 = E2 – E1
formülü çıkar. Termodinamikte enerji, maddenin yapısına bağlı iç enerji ve koordinat eksenlerine bağlı olan kinetik enerji (EK) ve potansiyel enerji (EP) olarak ayrılabilir;
- E = U + EK + EP
Sistemin herhangi bir hal değişimindeki enerjisi de;
- Q1-2 – W1-2 = E2 – E1 = (U2 – U1) + (1/2) m (V22 – V12) + m g (h2 – h1)
- U: iç enerji
- m: kütle
- V: hız
- g: yerçekimi ivmesi
- h: yükseklik
İkinci kanun
Termodinamiğin ikinci yasası şu şekildedir:
| « Isı, soğuk bir bölgeden sıcak bir bölgeye anında akamaz; başka bir deyişle, belirli bir sıcaklık derecesindeki ısı, tamamen işe dönüşemez.[2] » |
Bunun bir sonucu olarak, kapalı bir sistemin entropisi zaman içerisinde en yüksek değerine ulaşır. Yani, tüm kapalı sistemler bir denge hâline ulaşmaya meyleder ve bu denge hâlinde entropi en yüksek düzeyde iken iş yapabilecek enerji miktarı sıfırdır. Bu ileri-geri asimetrik süreç fizikte "zaman oku" denen kavramın yaratılmasına neden olmuştur.[2]
Bir ısı kaynağından ısı çekip buna eşit miktarda iş yapan ve başka hiçbir sonucu olmayan bir döngü elde etmek imkânsızdır. (Kelvin-Planck Bildirisi)
Verim asla 1'den büyük olamaz. Dolayısıyla tek kaynaktan ısı alarak çalışan bir makine yapmak olası değildir.
Soğuk bir cisimden sıcak bir cisme ısı akışı dışında bir etkisi olmayan bir işlem elde etmek imkânsızdır. (Clausius Bildirisi)
Termal olarak izole edilmiş büyük bir sistemin entropisi hiçbir zaman azalmaz (bkz: Maxwell'in Cini). Ancak mikroskopik bir sistem, yasanın dediğinin tersine entropi dalgalanmaları yaşayabilir (bkz: Dalgalanma Teoremi). Aslında, dalgalanma teoreminin zamana göre tersinebilir dinamik ve nedensellik ilkesinden çıkan matematiksel kanıtı ikinci yasanın bir kanıtını oluşturur. Mantıksal bakımdan ikinci yasa bu şekilde aslında fiziğin bir yasasından ziyade göreli olarak büyük sistemler ve uzun zamanlar için geçerli bir teoremi haline gelir. Ludwig Boltzmann tarafından tanımlanmıştır. Sisteme dışarıdan enerji verilmediği sürece düzenin düzensizliğe düzensizliğin de kaosa dönüşeceğini anlatır. Kırık bir bardağın durup dururken veya kırarken harcanan enerjiden daha azı kullanılarak eski haline döndürülemeyeceği örneği verilir klasik olarak. Yine aynı şekilde devrilen bir kitabı düzeltmek için devirirken harcanan enerjiden fazlasını kullanmak gerekir, potansiyel enerjinin bir kısmı ısıya dönüşmüştür ve geri getirilemez. Aynı zamanda Evren'deki düzensizlik eğilimini de anlatır. Düzensizlik eğilimini anlatırken entropi kelimesini kullanır. Yunanca, en = İngilizcedeki 'in' gibidir, önüne geldiği kelimeye -de, -da eki verir ve tropos = yol kelimesinin çoğulu olan 'tropoi' (tropi diye telaffuz edilir) kelimesinden. Yani; "yolda").
- Düzensizlik ya değişmez ya da artar. Örnek olarak difüzyon verilebilir. Ayrı duran maddeler bir arada olandan daha düzenlidir ve kendiliğinden karışmış sıcak ve soğuk sudan oluşmuş ılık suyun, bir daha sıcak ve soğuk diye ayrılması imkânsızdır.
- Eskime, yaşlanma, yıllanma gibi eylemlerin nedenidir.
- En düzensiz enerji ısıdır ve bir gün gelecek bütün enerji ısı olacaktır ve bu da Evren'in sonu demektir.
- İleri sürülecek teoriler termodinamiğin 2. kanunuyla çelişmemelidir.
- Entropi iş yapma yeteneği olmayan enerji olarak da tanımlanır. İki cam balona farklı sıcaklıklarda gaz, cam balonlar arasına da bir pervane konacak olursa ilk başta pervanenin döndüğünü görülecektir. Fakat sonra entropi arttığı için pervanenin dönmesi duracaktır.
- Spor yapmak için bir parkta 100 metrelik bir koşu yapıldığını, 100 metrenin sonunda yorulup koşamayacak hale gelindiğini ve bir yere oturulduğu düşünülecek olursa koşarken harcanmış olan ve bir daha kazanılamayacak olan enerjiye entropi denir.
- Sistemin düzensizliği arttıkça artan herhangi bir fonksiyon rahatça entropi fonsiyonu olabilir. Örneğin bir bardak suyumuz olduğunu ve bunun içine bir damla mürekkep damlatıp gözlediğimizi düşünelim ve içeride neler olduğunu hayal etmeye çalışalım. Mürekkep molekülleri başlangıçta kısa bir süre bir arada bekleştikten sonra su içine dağılmaya başlayacaklardır. Çünkü kendilerine çarpan su molekülleri tarafından değişik yönlere itileceklerdir (su ve mürekkep maddelerinin kimyasal bağlarının birbirlerini itmeye elverişli olmalarından dolayı). Şimdi de olağanüstü bir bilgisayarın, sistemin bütün mümkün durumlarını sayabildiğini düşünelim. Sistemin bir durumu denildiğinde anlamamız gereken şey bir molekülün belirli bir koordinata ve belirli bir hıza; bir başka molekülun bir başka belirli koordinata ve hıza sahip olduğu konfigürasyondur. Bardaktaki mürekkep örneğinde bu tür durumların sayısının çok fazla olduğu açıktır. Zîrâ bunların çok büyük bir kısmı mürekkebin moleküllerinin bardak içinde oraya buraya rastgele dağıldığı, düzensiz, yani yüksek entropili durumlara karşılık gelirler. Bizim algıladığımız düzeyde bunların hepsi homojen durumlardır. Çünkü karışıma baktığımızda o molekülün burada, bir başkasının şurada olmasına aldırmadan, mürekkebin homojen olarak dağıldığını söyleyebiliriz. Yani olağanüstü sayıda farklı mikroskopik durum tek bir makroskobik duruma, yani homojen duruma karşılık gelir.
- Aslında sistemler bozulmamakta, enerji değişimi bazında en kararlı hali almaya çalışmaktadırlar. Hayatın anlamı da budur, yaşam entropi yollarından biridir, şekerin çaya çok daha çabuk karışmasını sağlayan kaşık işlevindedir.
- Kapalı bir sistemde entropi her zaman artar. Kapalı sistem kısmı çok önemlidir. Sisteme enerji vermek suretiyle entropisi azaltılabilir. Dünya, kapalı bir sistem değildir. Güneş'ten sürekli olarak enerji akmaktadır ve düzeni bu sağlar.
- "Parçacık sayısı sonsuza giderken olması en muhtemel olan şey olur": Havaya bir miktar bozuk para atılsa hepsinin tura gelme ihtimali yalnızca birdir. Biri dışında hepsinin tura gelme ihtimali daha çoktur. Yarısının yazı, yarısının tura gelme ihtimali daha da çoktur.İşte bu sonuncusu maksimum entropiye sahip olan sistemdir. Sonuç olarak entropinin artması, sistemin muhtemel olmayan durumdan daha çok muhtemel olan duruma doğru gitmesi demektir. İçinde bulunulan odadaki moleküllerin hepsinin odanın sağ köşesindeki bir noktaya toplanması mümkünse de bu koşulu sağlayan yalnızca bir konfigürasyon vardır. Oysa atomların odanın her yerine eşit dağıldığı daha çok konfigürasyon vardır.
Üçüncü kanun
Üçüncü yasa şu şekildedir:
| « Sıcaklık mutlak sıfıra yaklaştıkça, en durağan hâlindeki bir elementin kusursuz bir kristalinin entropisi de sıfıra yaklaşır.[2] » |
Bu durum, istatistiksel bir bakış açısıyla, bir sistemdeki düzenin veya rastgeleliğin seviyesini belirleyen mutlak bir entropi ölçeği oluşturulmasına imkân verir.[2]
Bu yasa neden bir maddeyi mutlak sıfıra kadar soğutmanın imkânsız olduğunu izah eder; zîrâ sıcaklık mutlak sıfıra yaklaştıkça hareketlilik miktarı da sıfıra yaklaşır.
Sıcaklık mutlak sıfıra yaklaştıkça, bir sistemin entropisi bir sabite yaklaşır. Bu sayının sıfır değil de bir sabit olmasının sebebi, bütün hareketler durmasına ve buna bağlı olan belirsizliklerin yok olmasına rağmen kristal olmayan maddelerin moleküler dizilimlerinin farklı olmasından kaynaklanan bir belirsizliğin hâlâ mevcut olmasıdır. Ayrıca üçüncü yasa sayesinde maddelerin mutlak sıfırdaki entropileri referans alınmak üzere kimyasal tepkimelerin incelenmesinde çok yararlı olan mutlak entropi tanımlanabilir.
Alıntılar
"Bu evde termodinamik kurallarına uyarız!" (Lisa enerjisi zamanla artan bir devridaim makinası yaptıktan sonra ) – Homer Simpson
"Termodinamik komik bir konudur. İlk defa öğrendiğinizde, ne olduğunu anlamazsınız bile. İkinci defa üzerinden geçtiğinizde, bir-iki nokta hariç anladığınızı düşünürsünüz. Üçüncü defa baktığınızda ise, anlamadığınızı bilirsiniz, ama o zamana kadar konuya alıştığınız için bu sizi o kadar rahatsız etmez." – Arnold Sommerfeld
"Dökülen sütün arkasından ağlamayın, Evren'in bütün kuvvetleri sütü dökmeyi aklına koymuştu bir kez." - William Somerset Maugham
| Wikimedia Commons'ta Thermodynamics ile ilgili ortam dosyaları bulunmaktadır. |
Kaynakça
- "Thermodynamics" (İngilizce). Britannica. 29 Nisan 2015 tarihinde kaynağından (HTML) arşivlendi. Erişim tarihi: 5 Mart 2015.