Floroantimonik asit
Floroantimonik asit (HSbF6) hidrojen florür ve antimon pentaflorürün farklı oranlardaki karışımıdır.[1] Bu karışımlardan 1:1 kombinasyonu, bilinen en güçlü süperasit formunu oluşturur. Öyle ki, bu form, hidrokarbonları iyonize ederek karbokatyonlar ve H2 oluşturabilmektedir.[2]
| Floroantimonik asit | |
|---|---|
 |
 |
Fluoroantimonic acid | |
| Tanımlayıcılar | |
| CAS numarası | 16950-06-4 |
| PubChem | 21953576 |
| SMILES |
|
| Özellikler | |
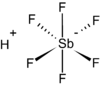
| Molekül formülü | HSbF6 |
| Molekül kütlesi | 236.76 g mol-1 |
| Görünüm | Renksiz sıvı |
| Tehlikeler | |
| Ana tehlikeler | Aşındırıcı |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Hidrojen florür (HF) ve SbF5 arasında gerçekleşen tepkime ekzotermiktir. Çok iyi bir oksitleyici olan HF, SbF5 moleküllerine saldırarak addüksiyon oluşumuna neden olur. Flooroantimonik molekülde, anyon, her ne kadar resmi olarak "koordinasyon bağı kurmayan" olarak tanımlansa da, hidrojene koordinasyon bağıyla bağlanır. Bunun sebebi, bu anyonun hem çok güçsüz bir nükleofil, hem de güçsüz bir baz olmasıdır.
Proton her ne kadar etkili bir şekilde "çıplak" olarak adlandırılsa da, gerçekte hidronyum katyonunda olan duruma benzer bir şekilde, florüre çok zayıf bir koordine kovalent bağ ile bağlanır.[3] Ancak bu bağın aşırı zayıflığı, sistemin aşırı asiditesine katkıda bulunur. Floroantimonik asit, %100'lük bir sülfürik asit çözeltisinden 2×1019 (20 kentilyon) kat daha güçlüdür.[4]
Yapı
HF-SbF5 karışımlarından, iki benzer ürün daha kristalize edilmiş olup her ikisi de tekli kristal X-ışını kristalografisince analiz edilmiştir. Bu tuzlar, [H2F+][Sb2F11−] ve [H3F2+][Sb2F11−] formundadır. Her iki tuzda da anyon, Sb2F11− kısmıdır.[5] Yukarıda da açıklandığı gibi, SbF6− çok zayıf bir baz olarak sınıflandırılır. Daha büyük olan monoanyon Sb2F11−'ninse daha güçsüz olması beklenir.
Diğer asitlerle karşılaştırılması
Aşağıdaki değerler, Hammett asitlik fonksiyonu temek alınarak hazırlanmıştır. Asidite, H0 değerinin büyük negatif değerlerine bağlıdır.
- Floroantimonik asit (1990) (H0 Değer = −31.3)
- Sihirli asit (1974) (H0 Değer = −19.2)
- Karboran süperasit (1969) (H0 Değer = −18.0)
- Florosülfürik asit (1944) (H0 Değer = −15.1)
- Triflik asit (1940) (H0 Değer = −14.9)
Kullanım
Bu aşırı güçlü asit, hemen hemen tüm organik bileşiği protonlar. 1967'de, Bickel ve Hogeveen, HF-SbF5 bileşiğinin, izobütandan H2'yi, neopentandan metanı koparabildiğini gösterdi:[6][7]
- (CH3)3CH + H+ → (CH3)3C+ + H2
- (CH3)4C + H+ → (CH3)3C+ + CH4
Güvenlik
HF-SbF5, suyla temasa geçtiğinde çok hızlı ve patlayıcı bir özellikte ayrışır. Bunun yanında bilinen tüm çözücülerle tepkimeye girer.[1] HF-SbF5 ile uyuşan çözücüler şu şekildedir: SO2ClF ve sıvılaştırılmış kükürt dioksit. Kloroflorokarbonlar da ayrıca çözücü olarak kullanılabilmektedir. HF-SbF5 bileşiklerini saklamak için yapılan konteynır ve kaplar PTFE'den üretilmektedir.
Ayrıca bakınız
- Floroborik asit
- Florosülfürik asit
Kaynakça
- Olah, G. A.; Prakash, G. K. S.; Wang, Q.; Li, X. “Hydrogen Fluoride–Antimony(V) Fluoride” in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- George Andrew Olah (2001). A life of magic chemistry: autobiographical reflections of a nobel prize winner. John Wiley and Sons. ss. 100-101. ISBN 0471157430.
- 27 Eylül 2011 tarihinde Wayback Machine sitesinde arşivlendi. The quantum chemistry of proton "hopping" or transfer in his acid. Accessed 2-27-2011.
- Olah, George A. (2005). "Crossing Conventional Boundaries in Half a Century of Research". J. Org. Chem. 70 (7). ss. 2413-2429. doi:10.1021/jo040285o. PMID 15787527.
- Mootz, D.; Bartmann, K. (1988). "The Fluoronium Ions H2F+ and H3F2+: Characterization by Crystal Structure Analysis". Angewandte Chemie, International Edition in English. Cilt 27. ss. 391-392. doi:10.1002/anie.198803911.
- Bickel, A. F.; Gaasbeek, C. J.; Hogeveen, H.; Oelderik, J. M.; Platteeuw, J. C. (1967). "Chemistry and spectroscopy in strongly acidic solutions: reversible reaction between aliphatic carbonium ions and hydrogen". Chemical Communications. Cilt 1967. ss. 634-5. doi:10.1039/C19670000634.
- Hogeveen, H.; Bickel, A. F. (1967). "Chemistry and spectroscopy in strongly acidic solutions: electrophilic substitution at alkane-carbon by protons". Chemical Communications. Cilt 1967. ss. 635-6. doi:10.1039/C19670000635.
