Sodyum bikarbonat
Sodyum bikarbonat ya da soda kimyasal formulü NaHCO3 olan bir kimyasal bileşiktir. Sodyum tuzlarından birisidir. Antiasit özelliği vardır. Kabartma tozu olarak da kullanılır. Suda çözünür. Beyaz katı kristal tozdur. Sodyum karbonat'ı andıran hafif alkali tadı vardır. Salin solüsyonu bileşiminde de kullanılır.[8]
| Sodyum bikarbonat | |
|---|---|
 | |
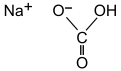 | |
 Sodyum katyonunun top ve çubuk modeli |
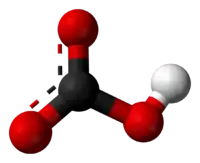 Bikarbonat anyonunun top ve çubuk modeli |
Sodyum hidrojen karbonat | |
Diğer adlar Yemek sodası, Cep sodası, Kabartma tozu | |
| Tanımlayıcılar | |
| CAS numarası | 144-55-8 |
| PubChem | 516892 |
| EC numarası | 205-633-8 |
| DrugBank | DB01390 |
| KEGG | C12603 |
| MeSH | Sodium+bicarbonate |
| ChEBI | 32139 |
| RTECS numarası | VZ0950000 |
| SMILES |
|
| InChI |
|
| Beilstein | 4153970 |
| ChemSpider | 8609 |
| Özellikler | |
| Molekül formülü | NaHCO3 |
| Molekül kütlesi | 84.0066 g mol−1 |
| Görünüm | Beyaz kristaller |
| Koku | Kokusuz |
| Yoğunluk |
|
| Çözünürlük (su içinde) | |
| Çözünürlük () | %0.02 aseton, %2.13 metanol @22 °C.[4] etanolde çözünmez |
| log P | −0.82 |
| Asitlik (pKa) | |
| Termokimya | |
Standart formasyon entalpisi (ΔfH |
−950.8 kJ/mol[6] |
Gibbs serbest enerjisi (ΔfG˚) |
−851.0 kJ/mol[6] |
| Farmakoloji | |
| AdminRoutes | Damar içi, oral |
| Yasal durum | {{{Legal_status}}} |
| Tehlikeler | |
| Ana tehlikeler | Ciddi göz tahrişine neden olur |
| NFPA 704 |
 0
0
1
|
| Parlama noktası | Yanmaz |
| LD50 | 4220 mg/kg (sıçan, oral)[7] |
| Benzeyen bileşikler | |
Diğer anyonlar |
Sodyum karbonat |
Diğer katyonlar |
|
Benzeyen bileşikler |
|
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |

Tarih
Eski Mısır’da doğal Natron çökeltileri,en çok sodyum karbonat dekahidrat ve sodyum bikarbonat içeren bir karışımdan oluşurdu.Natron hiyeroglif yazılar için boya olarak kullanılırdı.
1791 yılında fransız kimyager, Nicolas Leblanc soda olarak bilinen sodyum karbonatı üretti.1846 yılında New York’lu iki fırıncı,John Dwink ve Austin Church sodyum karbonat ve karbondioksit den kabartma tozu üreten ilk fabrikayı kurdu.
Bu bileşik 1800 lü yıllarda Roman kaptan, Rudyard Kipling tarafından balıkları taze tutmak amacıyla kullanılmış ve o günden sonra ‘saleratus’ olarak anılmıştır.
Üretim
Sodyum karbonat, sodyum hidroksitin sulu çözeltisi ile karbon dioksitin reaksiyonu ile elde edilebilir.
CO2 + 2 NaOH --> Na2CO3 + H2O
Sodyum bikarbonat ise yeterince yüksek yoğunlukta karbondioksit ve su tepkimesi ile elde edilebilir.Sodyum bikarbonat bu yöntemde katı olarak çökelir.Kabartma tozu ticari miktarda benzer bir yöntem ile üretilmektedir.
Na2CO3 + CO2 + H2O --> 2 NaHCO3
Fizyolojik ve farmakolojik özellikleri
Yüzde 1,3'lük çözeltisi izotonik özelliktedir.
Veteriner hekimlikte asidozis'in sağaltımında önem taşır.
Hiponatremi'nin sağaltımında kullanılır.
Kaynakça
- Haynes, p. 4.90
- Haynes, p. 5.194
- "Sodium Bicarbonate" (PDF). United Nations Environment Programme. 16 Mayıs 2011 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 13 Haziran 2020.
- Ellingboe JL, Runnels JH (1966). "Solubilities of Sodium Carbonate and Sodium Bicarbonate in Acetone-Water and Methanol-Water Mixtures". J. Chem. Eng. Data. 11 (3): 323-324. doi:10.1021/je60030a009.
- Haynes, p. 7.23
- Haynes, p. 5.19
- Chambers M. "Sodium bicarbonate [USP:JAN]". ChemIDplus. U.S. National Library of Medicine. 1 Ocak 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Haziran 2020.
- "Arşivlenmiş kopya". 7 Mart 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Mart 2016.