Sodyum bikromat
Sodyum bikromat Na2Cr2O7 formülüne sahip bir inorganik bileşiktir. Ancak, genellikle tuz dihidrat Na2Cr2O7•2H2O olarak kullanılır. Neredeyse tüm krom cevheri, sodyum bikromata dönüştürülerek işlenir ve neredeyse krom bazlı bütün bileşikler ve maddeler bu tuzdan hazırlanır.[1] Reaktivite ve görünüm açısından, sodyum bikromat ve potasyum bikromat çok benzerdir. Bununla birlikte sodyum tuzu, suda potasyum tuzundan yaklaşık yirmi kat daha fazla çözünür(0 °C’de 49 g/L) ve eşdeğer ağırlığı da daha düşüktür ki bu da genellikle istenen bir durumdur.[2]
| Sodyum bikromat | |
|---|---|
 | |
 | |
Sodyum bikromat | |
Diğer adlar Kromik asit disodyum tuzu | |
| Tanımlayıcılar | |
| CAS numarası | 10588-01-9 |
| PubChem | 25408 |
| EC numarası | 234-190-3 |
| UN numarası | 3288 |
| ChEBI | 39483 |
| RTECS numarası | HX7750000 HX7750000 (dihidrat) |
| SMILES |
|
| InChI |
|
| ChemSpider | 23723 |
| Özellikler | |
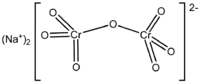
| Molekül formülü | Na2Cr2O7 |
| Molekül kütlesi | 261.97 g/mol (susuz) 298.00 g/mol (dihidrat) |
| Görünüm | parlak turuncu |
| Koku | kokusuz |
| Yoğunluk | 2.52 g/cm3 |
| Erime noktası |
356.7 °C |
| Kaynama noktası |
400 °C (bozunur) |
| Çözünürlük (su içinde) | 73 g/100 mL (25 °C) |
| Çözünürlük (diğer çözücüler içinde) | metanol, etanol‘de çözünür |
| Tehlikeler | |
| GHS piktogramları |      |
| R-ibareleri | R45, R46, R60, R61, R8, R21, R25, R26, R34, R42/43, R48/23, R50/53, |
| G-ibareleri | S53, S45, S60, S61 |
| H-ibareleri | H272, H301, H312, H314, H317, H330, H334, H340, H350, H360FD, H372, H410 |
| P-ibareleri | P201, P273, P280, P301+330+331, P302+352, P304+340, P305+351+338, P308+310 |
| NFPA 704 |
 0
4
1
|
| LD50 | 50 mg/kg |
| Benzeyen bileşikler | |
Diğer anyonlar |
Sodyum kromat Sodyum molibdat Sodyum tungstat |
Diğer katyonlar |
Potasyum bikromat Amonyum bikromat |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Üretimi
Sodyum bikromat, krom(III) oksitleri içeren cevherlerden büyük ölçekte üretilir. Cevher, hava varlığında (oksijen kaynağı) yaklaşık 1000 °C'de, bir baz tipik olarak sodyum karbonat ile eritilir:
- 2Cr2O3 + 4Na2CO3 + 3O2 -> 4Na2CrO4 + 4CO2
Bu aşama kromu çözündürür ve sıcak su içerisine ekstrakte edilmesini sağlar. Bu aşamada, cevherin alüminyum ve demir bileşikleri gibi diğer bileşenleri az çözünür. Elde edilen sulu ekstraktın sülfürik asit veya karbon dioksit ile asitleştirilmesi bikromatı verir:
- 2Na2CrO4 + 2CO2 + H2O -> Na2Cr2O7 + 2NaHCO3
- 2Na2CrO4 + H2SO4 -> Na2Cr2O7 + Na2SO4 + H2O
Bikromat, kristalizasyon yoluyla dihidrat olarak izole edilir. Bu şekilde, yılda milyonlarca kilogram sodyum bikromat üretilmektedir.
Krom(VI), özellikle toz olarak zehirli olduğu için, bu tür fabrikalar sıkı düzenlemelere tabidir. Örneğin, bu tür rafinerilerden çıkan atık maddeler, çevreyi daha az tehdit eden krom(VI) 'yı krom(III)' e geri döndürmek için indirgeyici maddelerle işlenir.[1] Bu tuzun, hekza-, tetra- ve dihidrattan 19.5 °C’nin altındaki dekahidrata (CAS# Şablon:CAS) kadar çeşitli hidratları bilinmektedir. 62 °C’nin üstünde, bu tuzlar bu tuzlar susuz maddeyi vermek için kendiliğinden su kaybederler. Sodyum bikromat yaklaşık 30 – 35 °C arasında kristalleşir.
Reaksiyonları
Bikromat ve kromat tuzları oksitleyici maddelerdir. Derinin tabaklanması için, sodyum bikromat önce kükürt dioksit ile indirgenir.
Organik sentez alanında,[2] bu bileşik benzilik ve allilik bağlarını karbonil türevlerine yükseltger. Örneğin, 2,4,6-trinitrotoluen karşılık gelen karboksilik aside yükseltgenir.[3] Benzer şekilde, 2,3-dimetilnaftalen Na2Cr2O7 ile 2,3-naftalandikarboksilik asite yükseltgenir.[4]
Sekonder alkoller karşılık gelen ketona yükseltgenir, örnk. mentolün mentona ;[5] dihidrokolestrolün kolestanona dönüşümü:[6]
- 3 R2CHOH + Cr2O72− + 2 H+ → 3 R2C=O + Cr2O3 + 4 H2O
Potasyum tuzuna göre, sodyum bikromatın ana avantajı, suda ve asetik asit gibi polar çözücülerde daha yüksek çözünürlüğüdür.
Sodyum bikromat florenin florenona dönüşümünde kullanılabilir.
Güvenlik
Bütün hekzavalent krom bileşikleri gibi, sodyum bikromatda kanserojendir.[7] Bileşik ayrıca aşındırıcıdır ve maruziyet ciddi göz hasarı veya körlüğe neden olabilir.[8] İnsan maruziyeti ayrıca doğurganlığı, kalıtsal genetik hasarı ve doğmamış çocuklara verilen zararı da kapsar.
Kaynakça
- Gerd Anger, Jost Halstenberg, Klaus Hochgeschwender, Christoph Scherhag, Ulrich Korallus, Herbert Knopf, Peter Schmidt, Manfred Ohlinger, "Chromium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. DOI:10.1002/14356007.a07_067
- Freeman, F. "Sodium Dichromate" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI:10.1002/047084289.
- Şablon:OrgSynth
- Şablon:OrgSynth
- Şablon:OrgSynth
- Şablon:OrgSynth
- IARC (2012) [17-24 Mart 2009]. Volume 100C: Arsenic, Metals, Fibres, and Dusts (PDF). Lyon: Uluslararası Kanser Araştırmaları Ajansı. ISBN 978-92-832-0135-9. 17 Mart 2020 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 5 Ocak 2020.
Krom (VI) bileşikleri kanserojenliği için insanlarda yeterli kanıt vardır. Krom (VI) bileşikleri akciğer kanserine neden olur. Ayrıca Krom (VI) bileşiklerine maruziyet ile burun ve burun sinüsleri kanseri arasında pozitif ilişki gözlenmiştir. Deney hayvanlarında krom (VI) bileşikleri kanserojenliği için yeterli kanıt vardır. Krom (VI) bileşikleri insanlar için kanserojen (Grup 1) dir.
- "ILO 1369 - Sodyum Bikromat". 15 Mart 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Temmuz 2020.