Sodyum karbonat
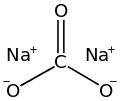
Sodyum karbonat, (çamaşır sodası, kristal soda ve soda külü olarak da bilinir) Na2CO3 formülüne sahip değişik hidratları olan bir inorganik bileşiktir. Bütün formları beyaz, suda çözünür tuzlardır. Tüm formları güçlü bir alkali tada sahiptir ve suda orta derecede alkali çözeltiler verir. Tarihsel olarak sodyum bakımından zengin göl sularından veya sodyum bakımından zengin topraklarda yetişen bitkilerin küllerinden çıkarıldı. Bu sodyum açısından zengin bitkilerin külleri, odun küllerinden (bir zamanlar potasa üretmek için kullanılıyordu) belirgin şekilde farklı olduğundan, sodyum karbonat "soda külü" olarak bilinir hale geldi.[9] Günümüzde ise, Solvay işlemi ile sodyum klorür ve kireç taşından büyük miktarlarda üretilmektedir.
| Sodyum karbonat | |
|---|---|
 | |
 | |
Sodyum karbonat | |
Diğer adlar Çamaşır sodası, Kristal soda, Soda külü | |
| Tanımlayıcılar | |
| CAS numarası | 497-19-8 |
| PubChem | 10340 |
| ChEBI | 29377 |
| RTECS numarası | VZ4050000 |
| SMILES |
|
| InChI |
|
| ChemSpider | 9916 |
| Özellikler | |
| Molekül formülü | Na2CO3 |
| Molekül kütlesi | 105.9888 g/mol (susuz) 286.1416 g/mol (dekahidrat) |
| Görünüm | Beyaz katı, higroskopik |
| Koku | Kokusuz |
| Yoğunluk | |
| Erime noktası |
851°C ((Susuz) |
| Çözünürlük (su içinde) | Susuz, g/100Şablon:NnbspmL:
|
| Çözünürlük (etandiol içinde) | alkali çözeltilerde,[4] gliserinde çözünür alkolde az çözünür CS2, aseton, alkil asetatlar, alkol, benzonitril, sıvı amonyakta çözünmez[5] |
| Çözünürlük (gliserin içinde) | 98.3 g/100Şablon:Nnbspg (155 °C)[5] |
| Çözünürlük () | 3.46 g/100Şablon:Nnbspg (20 °C)[6] |
| Çözünürlük (dimetilformamid içinde) | 0.5 g/kg[6] |
| Baziklik (pKb) | 3.67 |
| Yapı | |
Koordinasyon geometrisi |
Oktahedral (Na+, susuz) |
| Termokimya | |
Standart formasyon entalpisi (ΔfH |
−1130.7 kJ/mol[2][6] |
Gibbs serbest enerjisi (ΔfG˚) |
−1044.4 kJ/mol[2] |
| Tehlikeler | |
| GHS piktogramları |  [7] [7] |
| GHS İşaret sözcüğü | Uyarı |
| Ana tehlikeler | Tahriş edici |
| NFPA 704 |
 0
1
|
| LD50 | 4090 mg/kg (sıçan, oral)[8] |
| Benzeyen bileşikler | |
Diğer anyonlar |
Sodyum bikarbonat |
Diğer katyonlar |
Lityum karbonat Potasyum karbonat Rubidyum karbonat Sezyum karbonat |
Benzeyen bileşikler |
Sodyum seskikarbonat Sodyum perkarbonat |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Hidratları
Sodyum karbonat üç hidrat formda ve susuz tuz olarak üretilir:
- sodyum karbonat dekahidrat (natron), Na2CO3•10H2O, kolaylıkla çiçeklenerek monohidrat şekle dönüşür.
- sodyum karbonat heptahidrat (mineral formu bilinmiyor), Na2CO3•7H2O.
- sodyum karbonat monohidrat (termonatrit), Na2CO3•H2O. Kristal karbonat olarak da bilinir.
- kalsine edilmiş soda olarak da bilinen susuz sodyum karbonat, hidratların ısıtılmasıyla oluşur. Ayrıca, Solvay işleminin son aşamasında olduğu gibi sodyum bikarbonat ısıtıldığında (kalsine edildiğinde) da oluşur.
Dekahidrat -2.1 - +32 °C sıcaklık aralığındaki kristalleşen sulu çözeltilerden, heptahidrat 32 - 35.4 °C sıcaklıktaki dar aralıkta ve bu sıcaklığın üzerinde ise monohidrat form oluşur.[10] Kuru havada dekahidrat ve heptahidrat monohidratı vermek üzere su kaybeder. Diğer hidratlar da bilinmektedir, örn. sodyum karbonat birim başına 2.5 birim su ile ("pentahemihidrat").[11]
Kullanımı
Ana kullanımı
En büyük kullanım alanı olarak, sodyum karbonat cam, kağıt, suni ipek, sabun ve deterjan üretiminde kullanılır.[12]
Cam üretimi
Sodyum karbonat silika için bir akış görevi görür, karışımın erime noktasını özel malzemeler olmadan erişebilir bir noktaya düşürür. Bu "soda camı" hafifçe suda çözünür, bu nedenle camın çözünmez olması için eriyik karışımına bir miktar kalsiyum karbonat eklenir. Şişe ve pencere camı (Soda-kireç camı) sodyum karbonat, kalsiyum karbonat ve silis kumu (silisyum dioksit (SiO2)) gibi karışımların eritilmesiyle yapılır. Bu maddeler ısıtıldığında, karbonatlar karbon dioksit açığa çıkarır. Bu şekilde sodyum karbonat, bir sodyum oksit kaynağıdır. Soda kireç camı, yüzyıllardır en yaygın cam şekli olmuştur.
Su yumuşatma
Sodyum karbonat Mg2+ ve Ca2+ uzaklaştırıp suyu yumuşatmak için kullanılır. Bu iyonlar karbonat iyonları ile işleme tabi tutulduğunda çözünmeyen katı çökeltiler oluşturur:
- Ca2+ + CO32- → CaCO3
Sodyum karbonat ucuz ve suda çözünür bir karbonat iyonları kaynağıdır.
Gıda katkı maddesi ve pişirme
Sodyum karbonat bir asitlik düzenleyici, topaklanmayı önleyici madde, kabartma maddesi ve stabilizatör olarak kullanılan bir gıda katkı maddesidir (E500). Rāmen eriştelerine karakteristik lezzet ve dokusunu vermek için kullanılan ve bir alkali tuz çözeltisi olan kansui (かん水) bileşenlerinden biridir. Snus üretiminde son ürünün pH’ını stabilize etmek için kullanılır. Şerbet tozu üretiminde sodyum karbonat kullanılır. Serinlik ve fışırtı hissi, şerbet tükürük tarafından nemlendirildiğinde ortaya çıkan karbondioksit gazını serbest bırakan zayıf bir asit, genellikle sitrik asit ile sodyum karbonat arasındaki endotermik reaksiyondan kaynaklanır. Çin’de, geleneksel Kanton ay keklerinin kabuğunda ve diğer birçok Çin buğulanmış çörekler ve eriştelerde küllü suyun yerini almak için kullanılır. Pişirme işleminde, özellikle Alman pretzelleri(bir Alman simiti) ve lye ruloları(bir Alman ekmek türü)nda kostikleştirme için bazen sodyum hidroksit yerine kullanılır. Bu yemekler, yiyeceğin yüzeyinin pH'ını değiştirmek ve esmerleşmeyi iyileştirmek için bir alkali madde çözeltisi ile işlem görürler.
Ucuz, zayıf bir baz olarak kullanımı
Sodyum karbonat ayrıca çeşitli alanlarda nispeten güçlü bir baz olarak kullanılır. Basit bir alkali olarak, birçok kimyasal işlemde tercih edilir, çünkü NaOH'den daha ucuzdur ve kullanımı daha güvenlidir. Çok kuvvetli bir baz olmayışı özellikle ev içi uygulamalarda kullanılmasını önermek için iyi bir nedendir.
Örneğin, fotoğraf film banyosu maddelerinin çoğunun etkisi için gerekli kararlı alkali koşulları korumak için bir pH düzenleyicisi olarak kullanılır. Ayrıca istenen pH ve karbonat sertliğini (KH) korumak için yüzme havuzlarında ve akvaryum suyunda yaygın olarak kullanılan bir katkı maddesidir. Elyaf reaktif boyar maddelerle kumaş boyamada, boyar maddenin selüloz (bitki) lifleri ile uygun kimyasal bağlanmasını sağlamak için sodyum karbonat(genellikle soda külü fiksatörü veya soda külü aktivatörü gibi bir isim altında) kullanılır, Tipik olarak, bu işlem boyamadan önce (batik boyama), boyar madde ile (boyar maddenin boyaması için) karıştırılarak veya boyamadan sonra (daldırma boyama için) yapılır. Ayrıca, köpüklü yüzdürme işleminde kalsiyum oksit ve diğer hafif bazik bileşiklere ilaveten bir köpük düzeltici olarak uygun bir pH’I devam ettirmek için kullanılır.
Yanın söndürücülerin bir bileşeni olan sodyum bikarbonat (NaHCO3) veya yemek sodası, genellikle sodyum karbonattan üretilir. NaHCO3 ‘ın kendisi Solvay işleminin bir ara ürünü olmasına rağmen, ona bulaşmış olan amonyağın uzaklaştırılması için gerekli olan ısınma NaHCO3’ın birazını ayrıştırır ve imali tamamlanmış Na2CO3’ın CO2 ile reaksiyona girmesini daha ekonomik hale getirir:
- Na2CO3 + CO2 + H2O → 2NaHCO3
Benzeyen bir reaksiyonda, sodyum karbonat lignini selülozdan ayırmak için kullanılan "sülfit" yöntemi için gerekli sodyum bisülfit (NaHSO3) yapımında kullanılır. Bu reaksiyon, elektrik santrallerindeki baca gazlarından kükürt dioksiti uzaklaştırmak için kullanılır:
- Na2CO3 + SO2 + H2O → NaHCO3 + NaHSO3
Bu uygulama, özellikle santrallerin sıkı emisyon kontrollerini karşılaması gerektiğinde daha yaygın hale gelmiştir.
Sodyum karbonat, pamuk endüstrisi tarafından havlı pamuk tohumunun asitle linterlenmesi(havların temizlenmesi) için gereken sülfürik asidi nötralize etmek için kullanılır..
Diğer kullanım şekilleri
Sodyum karbonat, tuğla endüstrisi tarafından kili preslemek için gereken su miktarını azaltmaya yarayan bir ıslatıcı madde olarak kullanılır. Kalıplamada, "bağlayıcı madde" olarak adlandırılır ve ıslak aljinatın jelleşmiş aljinata yapışmasına izin vermek için kullanılır. Sodyum karbonat, köpük oluşturucu ve aşındırıcı olarak etki ettiği ve ağız pH'ını geçici olarak arttırdığı için diş macunlarında kullanılır.
Sodyum karbonat ayrıca hayvan postlarının işlenmesinde ve tabaklamada kullanılır.
Fiziksel özellikler
Ağırlıkça %10’luk sodyum karbonat çözeltisinin integral entalpisi −28.1 kJ/mol’dür.[13] Sodyum karbonat monohidratın Mohs sertliği 1.3’tür.[3]
Doğal mineral olarak oluşumu
Sodyum karbonat suda çözünür ve doğal olarak kurak bölgelerde, özellikle mevsimsel göller buharlaştığında oluşan mineral yataklarında (evaporitler) ortaya çıkabilir. Mineral natron tortuları, antik çağlardan beri, natronun mumyaların hazırlanmasında ve camın ilk imalatında kullanıldığı Mısır'daki kuru göl diplerinden çıkarılmıştır.
Sodyum karbonatın susuz mineral formu oldukça nadirdir ve natrit olarak adlandırılır. Sodyum karbonatın Tanzanya'nın eşsiz yanardağı Ol Doinyo Lengai'den püskürtüldüğü ve geçmişte diğer yanardağlardan da püskürtüldüğü varsayılmaktadır. Ancak bu minerallerin dünya yüzeyindeki dengesizlik nedeniyle erozyana uğraması muhtemeldir. Sodyum karbonatın üç mineralojik formunun yanı sıra trona (trisodyum hidrojendikarbonat dihidrat)ın tamamı, örneğin Rusya'daki Kola Yarımadasında meydana gelen ultra alkali pegmatitik kayalardan da bilinmektedir. Dünya dışı olarak bilinen sodyum karbonat nadirdir. Tortullar, yüzeye getirilen gezegen iç malzemesi olan Ceres'deki parlak noktaların kaynağı olarak tanımlanmıştır.[14] Mars yüzeyindeki karbonatlar varken ve bunların sodyum karbonat içermesi beklenirken,[15] tortulların henüz doğrulanmamış olmasına rağmen, bu yokluk daha önce sulu Mars toprağında düşük pH ın küresel baskınlığından dolayı açıklanmaktadır.[16]
Üretimi
Madencilik
Trona, trisodyum hidrojendikarbonat dihidrat (Na3HCO3CO3•2H2O) ABD'nin çeşitli bölgelerinde çıkarılır ve neredeyse tüm yerli sodyum karbonat tüketimini sağlar. 1938'de bulunan Green River, Wyoming yakınlarındaki gibi büyük doğal yatakların madenciliği, Kuzey Amerika'daki endüstriyel üretimden daha ekonomik hale getirdi. Türkiye'de önemli trona rezervleri vardır. Ankara yakınlarındaki rezervlerden iki milyon ton soda külü çıkarıldı. Ayrıca, Kenya'daki Magadi Gölü gibi bazı alkali göllerden dip tarama yapılarak çıkarılır. Sıcak tuzlu su kaynakları göldeki tuzu sürekli olarak yeniler, böylece tarama oranı ikmal oranından daha yüksek değilse, kaynak tamamen sürdürülebilir duruma gelmektedir.
Barilla ve kelp
Birçok "halofit" (tuza dayanıklı) bitki türü ve deniz yosunu türü, saf olmayan bir sodyum karbonat formu verecek şekilde işlenebilir. Bu kaynaklar Avrupa'da ve 19. yüzyılın başlarına kadar başka yerlerde hakimdi. Kara bitkileri (tipik olarak deniz börülcesi veya tuz otu) veya deniz yosunu (tipik olarak Fucus türleri) hasat edildi, kurutuldu ve yakıldı. Küller daha sonra bir alkali çözeltisi oluşturmak üzere "sıvılaştırıldı" (su ile yıkandı). Bu çözelti, "soda külü" olarak adlandırılan nihai ürünü oluşturmak üzere kaynatılıp, kurutuldu; bu çok eski isim, üretim için hasat edilen birçok deniz kıyısı bitki türünden biri olan deniz fasulyesinin bilimsel ismine uygulanmış Arapça soda kelimesinden türetilmiştir. "Barilla", kıyı bitkilerinden veya kelplerdan elde edilen saf olmayan bir potas formuna uygulanan ticari bir terimdir.[17]
Soda külü içindeki sodyum karbonat konsantrasyonu, deniz yosunundan türetilmiş form ("kelp") için yüzde 2–3'ten İspanya'daki tuz otu bitkilerinden üretilen en iyi barilla için yüzde 30'a kadar çok geniş bir şekilde değişti. Soda külü için bitki ve deniz yosunu kaynakları ve ayrıca ona benzeyen alkali "potas" için, 18. yüzyılın sonuna kadar gittikçe yetersiz hale geldi ve tuz ve diğer kimyasal maddelerden soda külü sentezlemek için, ticari olarak uygun yolların araştırılmasına ağırlık verildi.[18]
Leblanc işlemi
1792 yılında, Fransız kimyager Nicolas Leblanc tuz, sülfürik asit, kireç taşı ve kömürden sodyum karbonat üretmek için bir işlemin patentini aldı. İlk aşamada, sodyum klorür, Mannheim işleminde sülfürik asit ile işleme tabi tutulur. Bu reaksiyon sodyum sülfat (tuz keki) ve hidrojen klorür üretir:
- 2NaCl + H2SO4 → Na2SO4 + 2HCl
Tuz keki ve öğütülmüş kireç taşı (kalsiyum karbonat) kömürle ısıtılarak indirgenmiştir.[12] Bu dönüşüm iki bölümden oluşmaktadır. Birincisi, bir karbon kaynağı olan kömürün sülfatı sülfüre indirgediği karbotermik reaksiyon:
- Na2SO4 + 2C → Na2S + 2CO2
İkinci aşama, sodyum karbonat ve kalsiyum sülfür üretme reaksiyonudur:
- Na2S + CaCO3 → Na2CO3 + CaS
Bu karışıma kara kül denir. Soda külü kara külden su ile çıkarılır. Bu ekstraktın buharlaştırılması katı sodyum karbonat verir.
Leblanc işlemi tarafından üretilen hidroklorik asit, hava kirliliğinin önemli bir kaynağıydı ve kalsiyum sülfür yan ürünü de atık bertarafı sorunlarını ortaya çıkardı. Bununla birlikte, 1880'lerin sonlarına kadar sodyum karbonat için ana üretim yöntemi olarak kaldı.[18][19]
Solvay işlemi
1861 yılında, Belçikalı endüstriyel kimyager Ernest Solvay sodyum bikarbonat ve amonyum klorür üretmek için önce sodyum klorür, amonyak, su ve karbon dioksiti reaksiyona sokarak; sodyum karbonat yapmak için bir yöntem geliştirdi:[12]
- NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl
Elde edilen sodyum bikarbonat daha sonra ısıtılarak, su ve karbon dioksit açığa çıkararak sodyum karbonata dönüştürüldü:
- 2NaHCO3 → Na2CO3 + H2O + CO2
Bu arada amonyak, karbon dioksit oluşumundan kalan kireç (kalsiyum oksit) ile işlenerek amonyum klorür yan ürününden yeniden üretildi:
- 2NH4Cl + CaO → 2NH3 + CaCl2 + H2O
Solvay işlemi kullanılan amonyakı geri dönüştürür. Sadece tuzlu su ve kireçtaşı tüketir ve tek atık ürünü kalsiyum klorürdür. İşlem, iki atık ürün, kalsiyum sülfür ve hidrojen klorür üreten Leblanc işleminden önemli ölçüde daha ekonomiktir. Solvay işlemi hızla dünya çapında sodyum karbonat üretimine egemen oldu. 1900'e kadar sodyum karbonatın % 90'ı Solvay işlemi ile üretildi ve son Leblanc işlem tesisi 1920'lerin başında kapandı.[12]
Solvay işleminin ikinci aşaması olan sodyum bikarbonatın ısıtılması, ev pişirimlerinde ve restoranlarda küçük ölçekli olarak mutfak amaçlı sodyum karbonat yapmak için kullanılır(pretzel ve alkali erişteler dahil olmak üzere). Yöntem bu tür kullanıcılar için caziptir çünkü sodyum bikarbonat kabartma tozu olarak yaygın olarak satılmaktadır ve kabartma tozunu sodyum karbonata dönüştürmek için gereken 121 °C ile 149 °C sıcaklıklar geleneksel mutfak fırınlarında kolayca elde edilmektedir.[20]
Hou işlemi
Bu işlem 1930'larda Çinli kimyager Hou Debang tarafından geliştirildi. Daha öncesinde buhar reformasyonu yoluyla üretilen yan ürün karbondioksit, aşağıdaki reaksiyonlarla sodyum bikarbonat üretmek için doymuş bir sodyum klorür ve amonyak çözeltisi yoluyla pompalanır:
Sodyum bikarbonat, düşük çözünürlüğü nedeniyle bir çökelti olarak toplanır ve daha sonra Solvay işleminin son aşamasına benzer saf sodyum karbonat verecek şekilde yaklaşık 80 °C veya 95 °C'ye kadar ısıtılır. Geri kalan amonyum ve sodyum klorür çözeltisine daha fazla sodyum klorür ilave edilir; ayrıca bu çözeltiye 30-40 °C'de daha fazla amonyak pompalanır. Çözelti sıcaklığı daha sonra 10 °C 'nin altına düşürülür. Amonyum klorürün çözünürlüğü 30 °C'de sodyum klorürden daha yüksek ve 10 °C 'de daha düşüktür. Bu sıcaklığa bağlı çözünürlük farkı ve ortak iyon etkisi nedeniyle, amonyum klorür bir sodyum klorür çözeltisi içinde çöktürülür.
Hou işleminin Çince adı, lianhe zhijian fa (联合制碱法), "birleştirilmiş alkali üretim yöntemi" anlamına gelir: Hou işlemi Haber işlemine bağlıdır ve amonyakın artık yeniden üretilmeye ihtiyaç duyulmamasından dolayı, kalsiyum klorür üretimini ortadan kaldırarak daha iyi atom ekonomisi sunar. Yan ürün amonyum klorür, gübre olarak satılabilir.
Ayrıca bakınız
- Natron
- Sodyum karbonat kalıntı indeksi
- Sodyum bikarbonat
Kaynakça
- Şablon:CRC90
- Pradyot, Patnaik (2003). Handbook of Inorganic Chemicals. The McGraw-Hill Companies, Inc. s. 861. ISBN 978-0-07-049439-8.
- Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2nd bas.). New York: D. Van Nostrand Company. s. 633.
- Comey, Arthur Messinger; Hahn, Dorothy A. (Şubat 1921). A Dictionary of Chemical Solubilities: Inorganic (2nd bas.). New York: The MacMillan Company. ss. 208-209.
- Anatolievich, Kiper Ruslan. "sodium carbonate". chemister.ru. 6 Mayıs 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Temmuz 2014.
- Şablon:Sigma-Aldrich
- Chambers, Michael. "ChemIDplus - 497-19-8 - CDBYLPFSWZWCQE-UHFFFAOYSA-L - Sodium carbonate [NF] - Similar structures search, synonyms, formulas, resource links, and other chemical information". 16 Mayıs 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Haziran 2020.
- "minerals.usgs.gov/minerals" (PDF). 6 Temmuz 2012 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 14 Haziran 2020.
- T.W.Richards and A.H. Fiske (1914). "On the transition temperatures of the transition temperatures of the hydrates of sodium carbonate as fix points in thermometry". Journal of the American Chemical Society. 36 (3): 485-490. doi:10.1021/ja02180a003. 14 Haziran 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Haziran 2020.
- A. Pabst. "On the hydrates of sodium carbonate". 14 Kasım 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Haziran 2020.
- Christian Thieme (2000). "Sodium Carbonates". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_299. ISBN 978-3527306732.
- "Tatachemicals.com/north-america/product/images/fig_2_1.jpg". 11 Mart 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Haziran 2020.
- De Sanctis, M. C. (29 Haziran 2016). "Bright carbonate deposits as evidence of aqueous alteration on (1) Ceres". Nature. 536 (7614): 54-57. Bibcode:2016Natur.536...54D. doi:10.1038/nature18290. PMID 27362221.
- Jeffrey S. Kargel (23 Temmuz 2004). Mars - A Warmer, Wetter Planet. Springer Science & Business Media. ss. 399-. ISBN 978-1-85233-568-7. 30 Haziran 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Haziran 2020.
- Grotzinger, J. and R. Milliken (eds.) 2012. Sedimentary Geology of Mars. SEPM
- Hooper, Robert (1802). Lexicon Medicum (1848 bas.). Londra: Longman. ss. 1198-9. OCLC 27671024.
- Clow, Archibald and Clow, Nan L. (1952). Chemical Revolution, (Ayer Co Pub, June 1952), pp. 65–90. 0-8369-1909-2.
- Kiefer, David M. (Ocak 2002). "It was all about alkali". Today's Chemist at Work. 11 (1): 45-6. 4 Nisan 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Haziran 2020.
- McGee, Harold (24 Eylül 2010). "For Old-Fashioned Flavor, Bake the Baking Soda". The New York Times. 25 Nisan 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Nisan 2019.
Daha fazla bilgi için
- Eggeman, T. (2011). "Sodium Carbonate". Kirk-Othmer Encyclopedia of Chemical Technology. doi:10.1002/0471238961.1915040918012108.a01.pub3. ISBN 978-0471238966.
- Thieme, C. (2000). "Sodium Carbonates". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a24_299. ISBN 978-3527306732.
Dış bağlantılar
| Wikimedia Commons'ta Sodyum karbonat ile ilgili ortam dosyaları bulunmaktadır. |
- American Natural Soda Ash Company3 Ağustos 2020 tarihinde Wayback Machine sitesinde arşivlendi.
- Uluslararası Kimyasal Güvenlik Kartı 113521 Aralık 2016 tarihinde Wayback Machine sitesinde arşivlendi.
- FMC Wyoming Corporation
- Boyamada sodyum karbonat kullanımı23 Kasım 2016 tarihinde Wayback Machine sitesinde arşivlendi.
- Sodyum karbonat üretimi sentetik işlemle
- Hafif Sodaya genel bakış, üretim yöntemi ve uygulamaları