Sodyum azotür
Sodyum azotür NaN3 formüllü inorganik bileşik. Bu renksiz tuz çoğu araba hava yastığı sisteminde kullanılan gaz oluşturucusudur. Diğer azotür bileşiklerinin hazırlanabilmesi için de kullanılır. İyonik bir maddede olan sodyum azotür, suda oldukça iyi çözünür ve güçlü bir toksiktir.
| Sodyum azotür | |
|---|---|
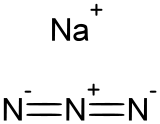 | |
 | |
Diğer adlar Sodyum trinitrür | |
| Tanımlayıcılar | |
| CAS numarası | 26628-22-8 |
| PubChem | 33557 |
| EC numarası | 247-852-1 |
| UN numarası | 1687 |
| ChEBI | 278547 |
| RTECS numarası | VY8050000 |
| SMILES |
|
| InChI |
|
| ChemSpider | 30958 |
| Özellikler | |
| Molekül formülü | NaN3 |
| Molekül kütlesi | 65.0099 g/mol |
| Görünüm | Beyaza kaçan reksiz katı |
| Koku | Kokusuz |
| Yoğunluk | 1.846 g/cm3 (20 °C) |
| Erime noktası |
275 °C (527 °F; 548 K) (Şiddetli bir biçimde bileşenlerine ayrışır.) |
| Çözünürlük (su içinde) | 38.9 g/100 mL (0 °C) 40.8 g/100 mL (20 °C) 55.3 g/100 mL (100 °C) |
| Çözünürlük () | Amonyakta çok iyi çözünür. Benzende az çözünür. Eter, aseton, hekzan ve kloroformda çözünmez. |
| Asitlik (pKa) | 4.8 |
| Termokimya | |
Standart formasyon entalpisi (ΔfH |
21.3 kJ/mol |
Gibbs serbest enerjisi (ΔfG˚) |
99.4 kJ/mol |
| Tehlikeler | |
| GHS piktogramları |     |
| GHS İşaret sözcüğü | TEHLİKE |
| NFPA 704 |
 1
4
3
|
| Parlama noktası | 300 °C |
| ABD maruz kalma limiti (PEL) |
yok[1] |
| LD50 | 27 mg/kg (oral, sıçan/fareler)[2] |
| Benzeyen bileşikler | |
Diğer anyonlar |
Sodyum siyanür |
Diğer katyonlar |
Potasyum azotür Amonyum azotür |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Hazırlanış
Sodyum azotür sentezi için yaygın bir metot olan "Wislicenus işlemi" amonyaktan başlayan 2 basamağı içerir.İlk basamakta, amonyak sodyum amide dönüştürülür:
- 2 Na + 2 NH3 → 2 NaNH2 + H2
Sonra sodyum amid, diazot monoksit ile birleştirilir:
- 2 NaNH2 + N2O → NaN3 + NaOH + NH3
Kimyasal Reaksiyonlar
Sodyum azotürün güçlü asitlerle işleme konulması oldukça toksik olan hidrazoik asitin oluşması ile sonuçlanır:
- H+ + N3- → HN3
Sulu çözeltileri yok denecek kadar hidrojen azit içerir:
- N3- + H
2O HN3 + OH- (K = 10−4.6
HN3 + OH- (K = 10−4.6
)
Sodyum azotür nitröz asit solusyonu ile işleme sokularak yok edilebilir.:[3]
- 2 NaN3 + 2 HNO2 → 3 N2 + 2 NO + 2 NaOH
Kaynakça
- "NIOSH Pocket Guide to Chemical Hazards #0560". National Institute for Occupational Safety and Health (NIOSH).
- Committee on Prudent Practices for Handling, Storage, and Disposal of Chemicals in Laboratories, Board on Chemical Sciences and Technology, Commission on Physical Sciences, Mathematics, and Applications, National Research Council (1995). "Disposal of Waste". Prudent Practices in the Laboratory: Handling and Disposal of Chemicals. Washington, DC: National Academy Press. s. 165. ISBN 0-309-05229-7. 25 Mart 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Mayıs 2016.
Dış bağlantılar
- International Chemical Safety Card 09503 Mart 2016 tarihinde Wayback Machine sitesinde arşivlendi..
- NIOSH Pocket Guide to Chemical Hazards11 Mayıs 2016 tarihinde Wayback Machine sitesinde arşivlendi..
- Straight Dope on Sodium Azide21 Ağustos 2008 tarihinde Wayback Machine sitesinde arşivlendi.