Retinal
Retinal, retinaldehid olarak da bilinir. Başlangıçta retinen[2] olarak adlandırılmıştı ve A vitamini aldehiti olduğu keşfedildikten sonra yeniden adlandırıldı[3].[4][5] Retinal, A vitamininin birçok vitamerinden biridir. Retinal, opsin olarak adlandırılan proteinlere bağlanan ve hayvanlarda görme olayının kimyasal temeli olan bir polien kromoforudur. Retinal bazı mikroorganizmalarda ışığın metabolik enerjiye dönüşmesini sağlar.
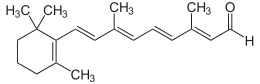
| All-trans-retinal | |
|---|---|
 | |
 | |
(2E,4E,6E,8E)-3,7-Dimetil-9-(2,6,6-trimetilsikloheksen-1-il)nona-2,4,6,8-tetraenal | |
Diğer adlar retinen; retinaldehit; vitamin A aldehit; RAL | |
| Tanımlayıcılar | |
| CAS numarası | 116-31-4 |
| PubChem | 638015 |
| SMILES |
|
| ChemSpider | 553582 |
| Özellikler | |
| Kimyasal formül | C20H28O |
| Molekül kütlesi | 284,44 g mol−1 |
| Görünüm | turuncu kristaller[1] |
| Erime noktası |
61°C-64°C (all-trans) 63,5–64,5 °C (11-cis) |
| Çözünürlük (su içinde) | Neredeyse çözünmez |
| Çözünürlük (yağ içinde) | Çözünür |
| Benzeyen bileşikler | |
Benzeyen bileşikler |
retinol; retinoi asit; beta-karoten; dehidroretinal; 3-hidroksiretinal; 4-hidroksiretinal |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Omurgalı hayvanlar, ya retinali doğrudan etten alırlar ya da karotenoidlerden (karotenler(α-karoten veya β-karoten) veya bir ksantofil türü olan β-kriptoksantin) retinal üretirler. Bu karotenoidler, bitkilerden veya diğer fotosentetik organizmalardan elde edilebilir. Başka hiçbir karotenoid hayvan tarafından retinale dönüştürülemez ve bazı etoburlar herhangi bir karotenoidi hiçbir şekilde dönüştüremez. A vitamininin diğer vitamerlerinden, retinol ve kısmen aktif bir formu olan retinoik asit, retinalden üretilebilir.
Böcekler ve kalamarlar gibi omurgasızlar, görsel sistemlerinde diğer ksantofillerin dönüşümünden türeyen, hidroksillenmiş retinal formları kullanırlar.
Metabolizma
Canlı organizmalar, karotenoidlerin geri dönüşümsüz oksidatif bölünmesiyle retinal (RAL) üretirler.[6] Örneğin,
- beta-karoten + O2 → 2 retinal
bir beta-karoten 15, 15'-monooksigenaz[7] veya bir beta-karoten 15, 15'-dioksijenaz ile katalize edilir.[8] Karotenoidler retinal prekürsörleri olduğu gibi, retina da A vitamininin diğer formlarının öncüsüdür.Retinal retinol ile interconvert olabilir. A vitamininin taşınması ve depolanması
retinol dehidrojenazlar[9] ve alkol dehidrojenazlar[10] tarafından katalize edilir. Retinol, A vitamini alkolü veya daha sık A vitamini olarak adlandırılır.
Retinal ayrıca retinaldehid dehidrojenazlar ve retinal oksidazlar olarak da bilinen retinal dehidrojenazlar tarafından katalize edilen retinoik aside oksitlenebilir.[10][11][12]
- retinal + NAD+ + H2O → retinoik asit + NADH + H+ (RALDH ile katalize edilen)
- retinal + O2 + H2O → retinoik asit + H2O2 (retinal oksidaz tarafından katalize edilen)
Bazen A vitamini asidi olarak da adlandırılan retinoik asit, omurgalı hayvanlarda önemli bir sinyal iletim molekülü ve hormonudur.
Görme
Görme, retinal fotoizomerizasyonu ile başlar. 11-cis-retinal kromofor bir fotonu emdiğinde, 11-cis durumundan all-trans durumuna izomerize olur. Kromoforun absorbans spektrumu, bağlı olduğu opsin proteini ile etkileşimlerine bağlıdır; Farklı opsinler farklı absorbans spektrumları üretir.
Görme döngüsü
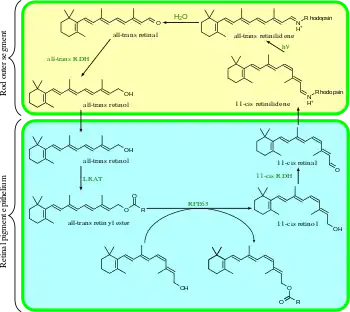
Görsel döngü, fototransfektin ön ucu olan dairesel bir enzimatik yoldur. 11-cis-retina yenilenir. Örneğin, memeli rod hücrelerinin görme döngüsü aşağıdaki gibidir:
- all-trans-retinil ester + H2O → 11-cis-retinol + yağ asidi; RPE65 izomerohidrolazlar,[13]
- 11-cis-retinol + NAD+ → 11-cis-retinal + NADH + H+; 11-cis-retinol dehidrogenazlar,
- 11-cis-retinal + aporodopsin → rodopsin + H2O; Schiff base-lizin bağı oluşur, -CH=N+H-,
- rodopsin + hν → metarodopsin II; 11-cis, all-trans'a fotoizomerize olur,
- rodopsin + hν → fotorodopsin → bathorodopsin → lumirodopsin → metarodopsin I → metarodopsin II,
- metarodopsin II + H2O → aporodopsin + all-trans-retinal,
- all-trans-retinal + NADPH + H+ → all-trans-retinol + NADP+; all-trans-retinol dehidrogenazlar,
- all-trans-retinol + yağ asidi → all-trans-retinil ester + H2O; lesitin retinol asiltransferazlar (LRATs).[14]
Rod hücre dış bölümlerinde adım 3,4,5,6 oluşur; Adım 1, 2 ve 7 retinal pigment epitelyum (RPE) hücrelerinde ortaya çıkar.
RPE65 izomerohidrolazlar, beta-karoten monoksijenazlar ile homologdur.[6]
Tip 1 rodopsinler
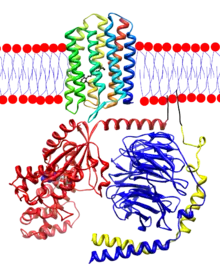
All-trans-retinal aynı zamanda tip I veya mikrobiyal, bakteriorodopsin, kanalrodopsin, ve halorodopsin gibi opsinlerin temel bir bileşenidir. Bu moleküllerde, ışık all-trans-retinalin, 13-cis retinale[15] dönüşmesine neden olur, karanlıkta all-trans-retinale geri dönüşür.
Tarihi
Amerikalı biyokimyacı George Wald ve diğerleri, 1958'de görme döngüsünü özetlemişlerdi. Wald, çalışması için, 1967 Nobel Fizyoloji/Tıp dalında ödül kazanmış, Haldan Keffer Hartline ve Ragnar Granit ile paylaşmıştır.[16]
Ayrıca bakınız
- Retinol
- Retinoid
- Karotenoid
- Retina
- Görme
- Duyu sistemi
- Görme fototransmisyon
Kaynakça
- Merck Index, 13th Edition, 8249
- WALD, GEORGE (14 Temmuz 1934). "Carotenoids and the Vitamin A Cycle in Vision". Nature. 134 (3376). ss. 65-65. doi:10.1038/134065a0.
- Wald, G (11 Ekim 1968). "Molecular basis of visual excitation". Science. 162 (3850). ss. 230-9. doi:10.1126/science.162.3850.230. PMID 4877437.
- MORTON, R. A.; GOODWIN, T. W. (1 Nisan 1944). "Preparation of Retinene in Vitro". Nature. 153 (3883). ss. 405-406. doi:10.1038/153405a0.
- BALL, S; GOODWIN, TW; MORTON, RA (1946). "Retinene1-vitamin A aldehyde". The Biochemical Journal. 40 (5–6). ss. lix. PMID 20341217.
- von Lintig, Johannes; Vogt, Klaus (2000). "Filling the Gap in Vitamin A Research: Molecular Identification of An Enzyme Cleaving Beta-carotene to Retinal". Journal of Biological Chemistry. 275 (16). ASBMB. ss. 11915-11920. doi:10.1074/jbc.275.16.11915. PMID 10766819.
- Woggon, Wolf-D. (2002). "Oxidative cleavage of carotenoids catalyzed by enzyme models and beta-carotene 15,15´-monooxygenase". Pure and Applied Chemistry. 74 (8). IUPAC. ss. 1397-1408. doi:10.1351/pac200274081397.
- Kim, Yeong-Su; Kim, Nam-Hee; Yeom, Soo-Jin; Kim, Seon-Won; Oh, Deok-Kun (2009). "In Vitro Characterization of a Recombinant Blh Protein from an Uncultured Marine Bacterium as a β-Carotene 15,15′-Dioxygenase". Journal of Biological Chemistry. 284 (23). ASBMB. ss. 15781-93. doi:10.1074/jbc.M109.002618. PMC 2708875 $2. PMID 19366683.
- Lidén, Martin; Eriksson, Ulf (2006). "Understanding Retinol Metabolism: Structure and Function of Retinol Dehydrogenases". Journal of Biological Chemistry. 281 (19). ASBMB. ss. 13001-13004. doi:10.1074/jbc.R500027200. PMID 16428379.
- Duester, G (Eylül 2008). "Retinoic Acid Synthesis and Signaling during Early Organogenesis". Cell. 134 (6). ss. 921-31. doi:10.1016/j.cell.2008.09.002. PMC 2632951 $2. PMID 18805086.
- Lin, Min; Zhang, Min; Abraham, Michael; Smith, Susan M.; Napoli, Joseph L. (2003). "Mouse Retinal Dehydrogenase 4 (RALDH4), Molecular Cloning, Cellular Expression, and Activity in 9-cis-Retinoic Acid Biosynthesis in Intact Cells". Journal of Biological Chemistry. 278 (11). ASBMB. ss. 9856-9861. doi:10.1074/jbc.M211417200. PMID 12519776.
- "KEGG ENZYME: 1.2.3.11 retinal oxidase". 13 Temmuz 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 10 Mart 2009.
- Moiseyev, Gennadiy; Chen, Ying; Takahashi, Yusuke; Wu, Bill X.; Ma, Jian-xing (2005). "RPE65 is the isomerohydrolase in the retinoid visual cycle". Proceedings of the National Academy of Sciences. 102 (35). ss. 12413-12418. Bibcode:2005PNAS..10212413M. doi:10.1073/pnas.0503460102. PMC 1194921 $2. PMID 16116091.
- Jin, Minghao; Yuan, Quan; Li, Songhua; Travis, Gabriel H. (2007). "Role of LRAT on the Retinoid Isomerase Activity and Membrane Association of Rpe65". Journal of Biological Chemistry. 282 (29). ASBMB. ss. 20915-20924. doi:10.1074/jbc.M701432200. PMC 2747659 $2. PMID 17504753.
- Chen, De-Liang; Wang, Guang-yu; Xu, Bing; Hu, Kun-Sheng (2002). "All-trans to 13-cis retinal isomerization in light-adapted bacteriorhodopsin at acidic pH". Journal of Photochemistry and Photobiology B: Biology. 66 (3). ss. 188-194. doi:10.1016/S1011-1344(02)00245-2.
- "1967 Nobel Prize in Medicine". 16 Şubat 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Mayıs 2018.