Etretinat
Etretinat (ticari adı Tegison), Hoffmann – La Roche tarafından geliştirilen ve 1986 yılında FDA tarafından şiddetli sedef hastalığının tedavisi için onaylanmış bir ilaçtır. İkinci jenerasyon bir retinoidtir.[1] Daha sonra, yüksek doğum kusurları riski nedeniyle, 1996'da Kanada pazarından ve 1998 yılında ABD pazarından çıkarıldı. Japonya'da pazarda Tigason olarak yer alır.
| Etretinat | |
|---|---|
 | |
 | |
| Sistematik (IUPAC) adı | |
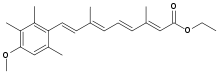
| Etil (2E,4E,6E,8E)-9-(4-metoksi-2,3,6-trimetilfenil)-3,7-dimetil-2,4,6,8-nonatetraenoat | |
| Kimlik belirteçleri | |
| CAS numarası | 54350-48-0 |
| ATC kodu | D05BB01 |
| PubChem | 5282375 |
| DrugBank | DB00926 |
| Kimyasal özellikler | |
| Kimyasal formül | C23H30O3 |
| Moleküler ağırlık | 354.483 g/mol |
| SMILES | search in eMolecules, PubChem |
| Farmakokinetik özellikler | |
| Proteine bağlanma | >99% |
| Yarılanma ömrü | 120 gün |
| Tedavi bilgileri | |
| Uygulama yolu | Oral |
Farmakoloji
Etretinat yüksek derecede lipofilik, aromatik bir retinoiddir. Adipoz dokuda depolanır ve buradan serbest bırakılır, böylece dozaj durduktan sonra bile etkileri uzun süre devam edebilir. Plazmada, tedaviyi takip eden üç yıla kadar tespit edilebilir. Etretinat düşük bir terapötik indeks ve 120 günlük[1] bir uzun eliminasyon yarı ömrüne (t1/2) sahiptir, bu da dozlamayı zorlaştırır.
Etretinatın metaboliti asitretindir. Asitretin daha az lipofiliktir ve 50 saatlik bir yarılanma ömrüne sahip olsa da vücutta etretinata kısmen metabolize olur,[1] böylece yine de uzun etkili bir teratojendir ve tedaviden sonraki iki yıl boyunca hamilelik yasaktır.[2]
Alınması gereken önlemler
- Etretinat teratojendir ve kullanımdan sonra doğum kusurlarına neden olabilir. Bu nedenle, tedavi sırasında ve tedavi durduktan sonra en az üç yıl boyunca doğum kontrolü önerilmektedir.[3]
- Kemik büyümesine müdahale edebileceğinden, çocuklarda etretinattan kaçınılmalıdır.[3]
- Eğer bir hasta herhangi bir dozda etretinata maruz kalmışsa, doğum kusurları riski nedeniyle Amerika Birleşik Devletleri'nde ve Birleşik Krallık'ta kan bağışında bulunmaya uygun değildir.[4] Japonya'da, insanlar ilacı kullanmayı bıraktıktan sonra iki yıl kan bağışında bulunamazlar.[5]
Yan etkiler
Yan etkileri hipervitaminoz A'nın tipik özellikleridir, genellikle;[3]
- kemik veya eklem ağrısı; uzun süreli tedavide diffüz idiopatik iskelet hiperostozu,
- kas veya karın krampları,
- kuruluk, yanma, kaşıntılı göz kapakları,
- sıra dışı morarmalardır.
Tarihi
İlaç, şiddetli sedef hastalığını tedavi etmek için 1986'da FDA tarafından onaylandı. Daha sonra, yüksek doğum kusurları riski nedeniyle, 1996'da Kanada pazarından ve 1998 yılında ABD pazarından çıkarıldı.[3][6][7]
Japonya'da ilaç Tigason markasıyla hâlâ pazardadır.[5]
Ayrıca bakınız
Kaynakça
- Mutschler, Ernst; Schäfer-Korting, Monika (2001). Arzneimittelwirkungen (Almanca) (8 bas.). Stuttgart: Wissenschaftliche Verlagsgesellschaft. s. 728f. ISBN 3-8047-1763-2.
- Jasek, W, (Ed.) (2007). Austria-Codex (Almanca) (62nd bas.). Viyana: Österreichischer Apothekerverlag. s. 5669. ISBN 978-3-85200-181-4.
- Drugs.com arşivi for etretinate
- UK Blood Transfusion and Tissue Transplantation Services
- Drug information sheet: Tigason 24 Eylül 2014 tarihinde Wayback Machine sitesinde arşivlendi.
- Qureshi, ZP; Seoane-Vazquez, E; Rodriguez-Monguio, R; Stevenson, KB; Szeinbach, SL (Temmuz 2011). "Market withdrawal of new molecular entities approved in the United States from 1980 to 2009". Pharmacoepidemiology and drug safety. 20 (7). ss. 772-7. doi:10.1002/pds.2155. PMID 21574210.
- Fung, M.; Thornton, A.; Mybeck, K.; Wu, J. H.-h.; Hornbuckle, K.; Muniz, E. (1 Ocak 2001). "Evaluation of the Characteristics of Safety Withdrawal of Prescription Drugs from Worldwide Pharmaceutical Markets-1960 to 1999". Therapeutic Innovation & Regulatory Science. 35 (1). ss. 293-317. doi:10.1177/009286150103500134.